С тех пор как Эдвард Дженнер впервые открыл вакцинацию в 18 веке, этот прорыв спас бесчисленное количество жизней. До внедрения вакцины против оспы в одной только Европе от этой болезни ежегодно умирало до 400 000 человек.
Традиционное лечение от этой болезни – вариоляционное – включало отбор образца у пациента с оспой и введение его кому-то, кто был подвержен заражению этой болезнью. Вариоляция была рискованной, учитывая, что традиционные медики сознательно внедряли вирус оспы в другого пациента.
Если доза была слишком высокой, пациент мог столкнуться с полной силой заболевания. Вакцина Дженнера, с другой стороны, применяла похожую технику, но гораздо более безопасную.
Она родилась из наблюдения, что доярки, которые ранее заразились коровьей оспой, не заболели обычной.
Эдвард Дженнер решил провести научную проверку. Он ввел 8-летнему мальчику болезнь коровьей оспы. После того, как мальчик выздоровел от коровьей оспы, Дженнер заразил мальчика оспой, которой болели люди. Мальчик не заболел этой болезнью, так как стал невосприимчивым к ней. Эта простая вакцина начала революцию в области здравоохранения, которая продолжается и по сей день.
Ученые обнаружили широкий спектр способов достижения иммунитета против болезней. Стратегия Дженнера теперь является одним из элементов оружия, которое широко диверсифицировалось за годы открытий и научных исследований.
Итак, какие стратегии вакцинации доступны нам сегодня? Чтобы понять, что входит в вакцину, и оценить нюансы современных разработок, важно понять, как организм приобретает иммунитет против болезней.
Иммунный ответ и память
Иммунная система реагирует на патогены двумя способами. Первый – это первичный ответ, при котором определенные иммунные клетки без разбора атакуют все, что они считают чужеродным. Если это не может нейтрализовать угрозу, иммунная система призывает свои более специализированные войска, что знаменует собой начало вторичной реакции.
Во вторичном ответе Т-клетки и В-клетки собираются, чтобы справиться с угрозой. В-клетки (В-лимфоциты) будут вырабатывать антитела – химические метки смерти, которые сигнализируют Т-клеткам и различным другим иммунным клеткам об уничтожения всего, что связано с антителом.
Эта система не только чрезвычайно эффективна, но и крайне важна для вакцинации, она может запомнить прошлые инфекции от патогенов. Если тот же самый патоген снова попадает в организм, иммунная система способна эффективно бороться и быстрее уничтожить его.
Следовательно, вакциной может быть все, что дает иммунной системе долговременную способность бороться с определенным заболеванием.
Этот вывод приводит нас к ключевому компоненту вакцины, который дает иммунной системе память о патогене, с которым он еще не боролся.
Существуют различные способы развития этого иммунитета, как будет объяснено ниже.
Живые аттенуированные вакцины
Живая аттенуированная вакцина – это путь, которым следовала вакцина Эдварда Дженнера от коровьей оспы. Как следует из названия, живые вакцины – это живые патогены, которые ослаблены, поэтому они больше не могут вызывать заболевание, но все же способны стимулировать иммунную систему.
Эта стимуляция приводит иммунные клетки к развитию памяти о болезни. Ослабленный патоген может быть непатогенным или менее патогенным видом или вариантом болезнетворного организма. Вирус коровьей оспы, использованный Дженнером, принадлежал к той же семье, что и вакцина против оспы, – и поэтому имел общие молекулярные маркеры, на которые иммунная система реагировала для борьбы с болезнью.
До настоящего времени живые ослабленные вакцины были одними из самых успешных вакцин в истории. Эти вакцины создают самую длинную память против патогена; во многих случаях людям требуется только одна вакцинация, чтобы обеспечить почти пожизненный иммунитет против болезни. Например, в вакцинах против оспы, кори и ветряной оспы, использовались живые ослабленные вакцины.
Инактивированная вакцина
Если живой аттенуированный патоген считается неосуществимым для создания иммунитета от заболевания (из-за безопасности, побочных эффектов или трудности в создании безопасного варианта), вводится мертвый или инактивированный патоген.
Возбудитель погибает в результате тепловой или химической обработки, а затем вводится в организм. Поскольку патоген все еще является чужеродным веществом и несет все патогенные маркеры, называемые антигенами, он способен генерировать иммунный ответ и вызывать формирование памяти.
Они не так эффективны, как живые вакцины, с точки зрения придания иммунитета организму, поэтому обычно нужно делать несколько прививок, называемых бустерами.
Субъединичные вакцины, ДНК и генная инженерия
Кроме того, существуют вакцины, в которые не вводится весь патоген. Вместо этого мы разрушаем патоген, идентифицируем антигены на патогене, а затем только вводим эти молекулы в организм.
Антиген может быть молекулой сахара в патогене, специфическим белком или, как в случае вируса, только его капсидом (внешняя оболочка). Мы можем изобретать комбинацию этих молекул разным путем, чтобы стимулировать иммунную систему именно так, как мы хотим.
Есть также ДНК-вакцины. Здесь вместо инъекции самой антигенной молекулы вводится ДНК, которая кодирует эти молекулы. Некоторые клетки-хозяева будут экспрессировать антигенный код в ДНК (это аномальное, но нормальное поведение клеток-хозяев), что приведет к иммунизации.
Помимо этого, существуют новые технологии вакцин, использующие различные методы генной инженерии, чтобы сделать вакцины более безопасными и высокоточными инструментами для борьбы с такими болезнями, как рак и ВИЧ.
Адъюванты, химические вакцины и другое:
Вакцины делаются не только из ослабленного патогена или антигенов в водном растворе.
Существуют адъюванты, консерванты, стабилизаторы, антибиотики и многое другое, чтобы обеспечить наилучшие шансы вакцины для организма. Разработчики вакцин тщательно сочетают идеальную формулу, которая поможет иммуногенной части вакцины справиться со своей задачей.
Это также та область, которая наиболее широко обсуждалась как в средствах массовой информации, так и в кругах теории заговора. Химические вещества, используемые для адъювантов, молекулы, которые усиливают иммунные свойства вакцины, подвергаются тщательному анализу на предмет их потенциальной токсичности для организма.
С учетом вышесказанного, адъювантные исследования направлены на решение потенциальных проблем со здоровьем и на попытки разработать молекулы, которые являются более безопасными и более эффективными, чем молекулы, использовавшиеся в прошлом.
Начиная с момента появления первой в мире вакцины, они спасли миллионы жизней. Например, вакцина против кори, разработанная Морисом Хиллеманом в 1963 году, по некоторым оценкам, предотвращает 1 миллион смертей в год.
Сегодня существует множество новых технологий, таких как мРНК-вакцины, а также адъюванты, разработанные с помощью рекомбинантных технологий. Эти новые стратегии дают надежду на создание вакцины против COVID-19, пандемия которого продолжается.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Виды вакцин и пути их введения
Виды вакцин
Вакцины состоят из действующего начала — специфического антигена; консерванта для сохранения стерильности (в неживых вакцинах); стабилизатора, или протектора, для повышения сроков сохраняемости антигена; неспецифического активатора (адъюванта), или полимерного носителя, для повышения иммуногенности антигена (в химических, молекулярных вакцинах). Специфические антигены, содержащиеся в вакцине, в ответ на введение в организм вызывают развитие иммунологических реакций, обеспечивающих устойчивость организма к патогенным микроорганизмам. В качестве антигенов при конструировании вакцин используют: живые ослабленные (аттенуированные) микроорганизмы; неживые (инактивированные, убитые) цельные микробные клетки или вирусные частицы; извлеченные из микроорганизмов сложные антигенные структуры (протективные антигены); продукты жизнедеятельности микроорганизмов — вторичные метаболиты (например, токсины, молекулярные протективные антигены): антигены, полученные путем химического синтеза или биосинтеза с применением методов генетической инженерии.
В соответствии с природой специфического антигена вакцины делят на живые, неживые и комбинированные (как живые, так и неживые микроорганизмы и их отдельные антигены). Живые вакцины получают из дивергентных (естественных) штаммов микроорганизмов, обладающих ослабленной вирулентностью для человека, но содержащих полноценный набор антигенов (например, вирус коровьей оспы), и из искусственных (аттенуированных) штаммов микроорганизмов. К живым вакцинам можно отнести также векторные вакцины, полученные генно-инженерным способом и представляющие собой вакцинный штамм, несущий ген чужеродного антигена (например, вирус оспенной вакцины со встроенным антигеном вируса гепатита В).
Неживые вакцины подразделяют на молекулярные (химические) и корпускулярные. Молекулярные вакцины конструируют на основе специфических протективных антигенов, находящихся в молекулярном виде и полученных путем биосинтеза или химического синтеза. К этим вакцинам можно отнести также анатоксины, которые представляют собой обезвреженные формалином молекулы токсинов, образуемых микробной клеткой (дифтерийный, столбнячный, ботулинический и др.). Корпускулярные вакцины получают из цельных микроорганизмов, инактивированных физическими (тепло, ультрафиолетовое и другие излучения) или химическими (фенол, спирт) методами (корпускулярные, вирусные и бактериальные вакцины), или из субклеточных над-молекулярных антигенных структур, извлеченных из микроорганизмов (субвирионные вакцины, сплит-вакцины, вакцины из сложных антигенных комплексов).
Молекулярные антигены, или сложные протективные антигены бактерий и вирусов, используют для получения синтетических и полусинтетических вакцин, представляющих собой комплекс из специфического антигена, полимерного носителя и адъюванта. Из отдельных вакцин (моновакцин), предназначенных для иммунизации против одной инфекции, готовят сложные препараты, состоящие из нескольких моновакцин. Такие ассоциированные вакцины, или поливакцины, поливалентные вакцины обеспечивают иммунитет одновременно против нескольких инфекций. Примером может служить ассоциированная АКДС-вакцина, в состав которой входят адсорбированные дифтерийный и столбнячный анатоксины и коклюшный корпускулярный антиген. Существует также семейство полианатоксинов: ботулинический пентаанатоксин, противогангренозный тетраанатоксин, дифтерийно-столбнячный дианатоксин. Для профилактики полиомиелита применяют единый поливалентный препарат, состоящий из аттенуироваиных штаммов I, II, III серотипов (сероваров) вируса полиомиелита.
Насчитывается около 30 вакцинных препаратов, применяемых с целью профилактики инфекционных болезней; примерно половина из них живые, остальные инактивированные. Среди живых вакцин выделяют бактерийные — сибиреязвенную, чумную, туляремийную, туберкулезную, против Ку-лихорадки; вирусные — оспенную, коревую, гриппозную, полиомиелитную, паротитную, против желтой лихорадки, краснухи. Из неживых вакцин применяют коклюшную, дизентерийную, брюшнотифозную, холерную, герпетическую, сыпнотифозную, против клещевого энцефалита, геморрагических лихорадок и другие, а также анатоксины — дифтерийный, столбнячный, ботулинический, газовой гангрены.
Основным свойством вакцин является создание активного поствакцинального иммунитета, который по своему характеру и конечному эффекту соответствует постинфекционному иммунитету, иногда отличаясь от него лишь количественно. Вакцинальный процесс при введении живых вакцин сводится к размножению и генерализации аттенуированного штамма в организме привитого и вовлечению в процесс иммунной системы. Хотя по характеру поствакцинальных реакций при введении живых вакцин вакцинальный процесс и напоминает инфекционный, однако он отличается от него своим доброкачественным течением.
Вакцины при введении в организм вызывают ответную иммунную реакцию, которая в зависимости от природы иммунитета и свойств антигена может носить выраженный гуморальный, клеточный или клеточно-гуморальный характер.
Эффективность применения вакцин определяется иммунологической реактивностью, зависящей от генетических и фенотипических особенностей организма, от качества антигена, дозы, кратности и интервала между прививками. Поэтому для каждой вакцины разрабатывают схему вакцинации.
В зависимости от способа применения вакцины делят на инъекционные, пероральные и ингаляционные. В соответствии с этим им придается соответствующая лекарственная форма: для инъекций применяют исходные жидкие или регидратированные из сухого состояния вакцины; пероральные вакцины — в виде таблеток, конфет (драже) или капсул; для ингаляций используют сухие (пылевые или регидратированные) вакцины.
Вакцины будущего
- Генно-инженерные вакцины. В геном живых аттенуированных вирусов, бактерий, дрожжей или клеток эукариотов встраивается ген, кодирующий образование протективного антигена того возбудителя, против которого направлена вакцина.
- Синтетические пептидные вакцины. Могут содержать различные эпитопы, способные формировать иммунитет к разным видам инфекций. Отличаются высокой степенью стандартности, безопасны, однако слабо иммуногенны и требуют применения эффективных адъювантов.
- ДНК-вакцины — вакцины из плазмидных ДНК, кодирующих протективные антигены возбудителей инфекционных заболеваний. Такая ДНК при введении в организм проникает в ядро клетки, длительное время существует вне хромосом без репликации, транскрибируется и экспрессирует соответствующие антигены, вызывающие в организме формирование T- и B-клеточного иммунитета.
- Антиидиотипические вакцины. Антиидиотипические антитела являются зеркальным отражением антигена и поэтому способны вызывать образование антител и цитотоксических клеток, реагирующих с антигеном. Вакцины на основе антиидиотипических антител безопасны, так как идиотипы являются естественными эндогенными регуляторами иммунного ответа.
- Вакцины, содержащие продукты генов гистосовместимости. Каждой инфекции соответствует свой набор антигенов гистосовместимости, отвечающий за высокий уровень иммунного ответа. Отсутствие на клетках таких антигенов является одной из основных генетических причин слабой иммунной реакции. Введение в организм молекул гистосовместимости, несущих пептиды, соответствующие эпитопам инфекционных агентов, будет способствовать усилению иммунитета.
- Растительные вакцины. Продемонстрировано, что в листьях трансгенного табака могут нарабатываться белки инфекционных вирусов. После очистки такие белки можно использовать как компоненты вакцин. Немаловажное значение имеет высокая экономичность растительных вакцин и возможность их применения с пищей.
- Мукозальные вакцины. Один из подходов к созданию таких вакцин заключается в разработке средств, препятствующих колонизации возбудителей инфекций на поверхности слизистых оболочек. Основу таких вакцин может составить белок адгезии на концах бактериальных пилей, с помощью которых бактерии прикрепляются к поверхности слизистой.
Пути введения вакцин
Внутримышечный путь введения вакцин
Наиболее предпочтительный путь для введения вакцин. Хорошее кровоснабжение мышц гарантирует и максимальную скорость выработки иммунитета, и максимальную его интенсивность, поскольку большее число иммунных клеток имеет возможность «познакомиться» с вакцинными антигенами. Удаленность мышц от кожного покрова обеспечивает меньшее число побочных реакций, которые в случае внутримышечного введения сводятся лишь к некоторому дискомфорту при активных движениях в мышцах в течение 1-2 дней после вакцинации.
Место введения: Вводить вакцины в ягодичную область крайне не рекомендуется. Во-первых, иглы шприц-доз большинства импортных вакцин недостаточно длинны (15 мм) для того, чтобы достичь ягодичной мышцы, в то время, как известно, и у детей, и у взрослых кожно-жировой слой может иметь значительную толщину. Если вакцина вводится в ягодичную область, то она по сути вводится подкожно. Следует также помнить о том, что любая инъекция в ягодичную область сопровождается определенным риском повреждения седалищного нерва у людей с анатомическими особенностями его прохождения в мышцах.
Предпочтительным местом введения вакцин у детей до 3 лет является передне-боковая поверхность бедра в средней его трети. Это объясняется тем, что мышечная масса в этом месте значительна при том, что подкожно-жировой слой развит слабее, чем в ягодичной области (особенно у детей, которые еще не ходят).
У детей старше двух лет и взрослых предпочтительным местом введения вакцин является дельтовидная мышца (мышечное утолщение в верхней части плеча, над головкой плечевой кости), в связи с небольшой толщиной кожного покрова и достаточной мышечной массой для всасывания 0,5-1,0 мл вакцинного препарата. У детей младших возрастов это место введения вакцин не используется в связи с недостаточным развитием мышечной массы и большей болезненностью.
Техника вакцинации: Независимо от выбранного места введения вакцины внутримышечная инъекция должна быть произведена перпенди кулярно, то есть под углом 90 градусов к поверхности кожи. При введении вакцины в дельтовидную мышцу инъекция производится строго сбоку, положение шприца должно быть строго горизонтальным.
Так называемая техника Z-track состоит в том, что перед инъекцией кожа сдвигается в одном из направлений и отпускается после того, как игла будет выведена. С одной стороны – прохождение иглы через натянутую кожу менее болезненно, с другой стороны, за счет смещения канала, вакцина как бы «запечатывается» в мышце.
Преимущества: хорошее всасывание вакцины и, как следствие, высокая иммуногенность и скорость выработки иммунитета. Меньшее число местных побочных реакций. Точность введенной дозы (по сравнению с внутрикожным и пероральным способом введения).
Недостатки: Субъективное восприятие детьми младшего возраста внутримышечных инъекций несколько хуже, чем при других способах вакцинации.
Пероральный (т.е. через рот)
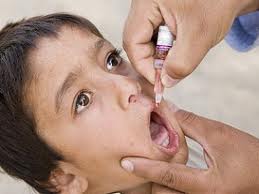 Классическим примером пероральной вакцины является ОПВ – живая полиомиелитная вакцина. Обычно таким образом вводятся живые вакцины, защищающие от кишечных инфекций (полиомиелит, брюшной тиф). Впрочем, сейчас разрабатываются пероральные вакцины, которые будут защищать не только от кишечных инфекций – вакцина против ВИЧ-инфекции на бактериальном носителе (сальмонелла).
Классическим примером пероральной вакцины является ОПВ – живая полиомиелитная вакцина. Обычно таким образом вводятся живые вакцины, защищающие от кишечных инфекций (полиомиелит, брюшной тиф). Впрочем, сейчас разрабатываются пероральные вакцины, которые будут защищать не только от кишечных инфекций – вакцина против ВИЧ-инфекции на бактериальном носителе (сальмонелла).
Техника пероральной вакцинации: несколько капель вакцины закапываются в рот. Если вакцина имеет неприятный вкус, ее закапывают либо на кусочек сахара, либо печенья.
Преимущества такого пути введения вакцины очевидны: для такой вакцинации не требуется специального образования и подготовки, простота метода, его быстрота, экономия на привлечении квалифицированного персонала.
Недостатками перорального введения вакцин следует считать разлив вакцины, неточность дозировки вакцины (часть препарата выводится с калом, не сработав), экономические потери на необходимости повторных введений вакцины и ее разливе.
Внутрикожный и накожный
Классическим примером вакцины, предназначенной для внутрикожного введения, является БЦЖ. Примерами вакцин с внутрикожным введением являются живая туляремийная вакцина и вакцина против натуральной оспы. Как правило, внутрикожно вводятся живые бактериальные вакцины, распространение микробов из которых по всему организму крайне нежелательно. Однако в последнее время, внутрикожное введение вакцин в ряде стран стало использоваться в целях экономии вакцины (для такой вакцинации требуется меньший объем вакцины) – так, к примеру, в некоторых странах прививают против бешенства. И ВОЗ, идя навстречу пожеланиям медработников, разработало рекомендации по внутрикожному введению антирабических вакцин. Для других вакцин, кроме названных, внутрикожный путь введения пока не рекомендован.
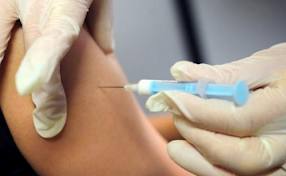
Техника: Традиционным местом для накожного введения вакцин является либо плечо (над дельтовидной мышцей), либо предплечье – середина между запястьем и локтевым сгибом. Для внутрикожного введения должны использоваться специальные шприцы со специальными, тонкими иглами. Иголочку вводят вверх срезом, практически параллельно поверхности кожи, оттягивая кожу вверх. При этом необходимо убедиться, что игла не проникла под кожу. О правильности введения будет свидетельствовать образование специфической «лимонной корочки» в месте введения – белесый оттенок кожи с характерными углублениями на месте выхода протоков кожных желез. Если «лимонная корочка» не образуется во время введения, значит вакцина вводится неверно.
Преимущества: Низкая антигенная нагрузка, относительная безболезненность.
Недостатки: Довольно сложная техника вакцинации, требующая специальной подготовки. Возможность неправильно ввести вакцину, что может привести к поствакцинальным осложнениям.
Подкожный путь введения вакцин
Довольно традиционный путь введения вакцин и других иммунобиологических препаратов на территории бывшего СССР, хорошо известный всем уколами «под лопатку» (так вводятся гангренозные и стрептококковые анатоксины). В целом этот путь подходит для живых и инактивированных вакцин, хотя предпочтительно использовать его именно для живых (корь-паротит-краснуха, желтая лихорадка и др.). В связи с тем, при подкожном введении несколько снижается иммуногенность и скорость выработки иммунного ответа, этот путь введения крайне нежелателен для введения вакцин против бешенства и вирусного гепатита В.
Подкожный путь введения вакцин желателен для пациентов с расстройствами свертывания крови – риск кровотечений у таких пациентов после подкожной инъекции значительно ниже, чем при внутримышечном введении.
Техника: Местом вакцинации могут быть как плечо (боковая поверхность середины между плечевым и локтевым суставами), так и передне-боковая поверхность средней трети бедра. Указательным и большим пальцами кожа берется в складку и, под небольшим углом, игла вводится под кожу. Если подкожный слой у пациента выражен значительно, формирование складки не критично.
Преимущества: Сравнительная простота техники, незначительно меньшая болезненность (что несущественно у детей) по сравнению с внутримышечной инъекцией. В отличие от внутрикожного введения, можно ввести больший объем вакцины или другого иммунобиологического препарата. Точность введенной дозы (по сравнению с внутрикожным и пероральным способом введения).
Недостатки: «Депонирование» вакцины и как следствие – меньшая скорость выработки иммунитета и его интенсивность при введении инактивированных вакцин. Большее число местных реакций — покраснений и уплотнений в месте введения.
Аэрозольный, интраназальный (т.е. через нос)
Считается, что подобный путь введения вакцин улучшает иммунитет во входных воротах воздушно-капельных инфекций (корь, грипп, краснуха) за счет создания иммунологического барьера на слизистых оболочках. В то же время, созданный таким образом иммунитет не является стойким, и в то же время общий (т.н. системный) иммунитет может оказаться недостаточным для борьбы с уже проникшими через барьер на слизистых в организм бактериями и вирусами.
Типичным примером интраназальной вакцины является одна из отечественных противогриппозных вакцин.
Техника аэрозольной вакцинации: несколько капель вакцины закапываются в нос либо распыляются в носовых ходах с помощью специального устройства.
Преимущества такого пути введения вакцины очевидны: как и для пероральной вакцинации, для аэрозольного введения не требуется специального образования и подготовки; такая вакцинация создает отличный иммунитет на слизистых оболочках верхних дыхательных путей.
Недостатками перорального введения вакцин следует считать существенный разлив вакцины, потери вакцины (часть препарата попадает в желудок), недостаточный общий иммунитет.
Открытие метода вакцинации дало старт новой эре борьбы с болезнями.
В состав прививочного материала входят убитые или сильно ослабленные микроорганизмы либо их компоненты (части). Они служат своеобразным муляжом, обучающим иммунную систему давать правильный ответ инфекционным атакам. Вещества, входящие в состав вакцины (прививки), не способны вызвать полноценное заболевание, но могут дать возможность иммунитету запомнить характерные признаки микробов и при встрече с настоящим возбудителем быстро его определить и уничтожить.
Производство вакцин получило массовые масштабы в начале ХХ века, после того как фармацевты научились обезвреживать токсины бактерий. Процесс ослабления потенциальных возбудителей инфекций получил название аттенуации.
Сегодня медицина располагает более, чем 100 видами вакцин от десятков инфекций.
Препараты для иммунизации по основным характеристикам делятся на три основных класса:
- Живые вакцины. Защищают от полиомиелита, кори, краснухи, гриппа, эпидемического паротита, ветряной оспы, туберкулеза, ротавирусной инфекции. Основу препарата составляют ослабленные микроорганизмы — возбудители болезней. Их сил недостаточно для развития значительного недомогания у пациента, но хватает, чтобы выработать адекватный иммунный ответ.
- Инактивированные вакцины. Прививки против гриппа, брюшного тифа, клещевого энцефалита, бешенства, гепатита А, менингококковой инфекции и др. В составе мертвые (убитые) бактерии или их фрагменты.
- Анатоксины (токсоиды). Особым образом обработанные токсины бактерий. На их основе делают прививочный материал от коклюша, столбняка, дифтерии.
В последние годы появился еще один вид вакцин — молекулярные. Материалом для них становятся рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии (рекомбининтная вакцина против вирусного гепатита В).
Источник: Специалисты о прививках
Прививки. Эта тема вызывает много вопросов среди родителей и медиков. В этой статье предлагаю просто познакомиться с вакцинами — препаратами, которые вводятся в качестве прививки. Откуда они взялись? Какие бывают? Что входит в их состав?
Появление вакцин связывают с именем английского врача Эдуарда Дженнера, который в 1796 году привил ребенку коровью оспу, и ребенок после прививки не заболел в период эпидемии оспы натуральной.
Спустя сто лет французский ученый Луи Пастер сделал гениальное открытие, что если понизить ядовитость микроорганизма, то он превращается из причины болезни в средство защиты от нее. Но первые вакцины, созданные опытным путем, появились задолго до этого открытия!
Конечно, они не идут ни в какое сравнение с современным препаратами, применяемыми в медицине.
Итак, вакцины – это препараты, получаемые из микроорганизмов и продуктов их жизнедеятельности, предназначенные для активной иммунизации человека против инфекций, вызываемых этими микроорганизмами. © https://lady.webnice.ru
 Из чего состоит вакцина
Из чего состоит вакцина
Собственно, эти микроорганизмы, либо их части, являются антигенами – главными компонентами вакцин.
В ответ на введение вакцины у человека вырабатываются антитела – вещества, убивающие микроорганизмы-возбудители заболевания, и при встрече с реальной болезнью он оказывается «во всеоружии» против нее.
К антигенам часто добавляют адъюванты (лат. adjuvans — помогающий, поддерживающий). Это вещества, стимулирующие образование антител, и позволяющие снизить количество антигена в вакцине. В качестве адъювантов используются полиоксидоний, фосфат или гидроксид алюминия, агар и некоторые протамины.
Полиоксидоний – это иммуномодулятор, который способен «подстраиваться» под конкретный организм: повышает пониженные показатели иммунитета и понижает повышенные. Еще он выводит токсины и связывает свободные радикалы.
Гидроксид алюминия благодаря своей высокой адсорбирующей способности выполняет роль депо, а также «умеет» незначительно стимулировать некоторые иммунные реакции при вакцинации.
Благодаря органическим адъювантам (протамины) антиген доставляется непосредственно к иммунным клеткам, что стимулирует иммунный ответ.
Помимо антигенов в состав вакцин входят стабилизаторы – вещества, обеспечивающие стабильность антигена (предотвращают его распад). Это вещества, широко применяемые в фармацевтической промышленности и в медицине: альбумин, сахароза, лактоза. Они не влияют на развитие осложнений после вакцинации.
Также в вакцины добавляют консерванты – это вещества, обеспечивающие стерильность вакцин. Они используются не во всех вакцинах, в основном в многодозовых. В качестве консерванта чаще всего выступает мертиолят. Это органическая соль ртути, свободной ртути там нет.
Какие бывают вакцины
По качеству антигена вакцины делят на живые и инактивированные.
Живые вакцины содержат живые, но ослабленные микроорганизмы. Попав в организм человека, они начинают размножаться, не вызывая заболевания (возможны отдельные неярко выраженные симптомы), но заставляют организм вырабатывать защитные антитела. Иммунитет после введения живых вакцин длительный и стойкий.
К живым вакцинам относятся полиомиелитная (есть и инактивированная полиомиелитная вакцина), коревая, краснушная, паротитная, вакцина БЦЖ (против туберкулеза).
 Инактивированные вакцины могут содержать целые убитые микробные тела (цельноклеточные вакцины). Это, например, вакцина против коклюша, некоторые вакцины против гриппа.
Инактивированные вакцины могут содержать целые убитые микробные тела (цельноклеточные вакцины). Это, например, вакцина против коклюша, некоторые вакцины против гриппа.
Есть инактивированные вакцины, в которых микробные тела расщеплены на отдельные составляющие (сплит-вакцины). Это вакцина против гриппа «Ваксигрипп» и некоторые другие.
Если химическим путем извлечь из микроба только антигены, то получаются химические вакцины. Таким путем получены вакцины против менингита, пневмококка, гемофильной палочки.
Новое поколение инактивированных вакцин — ДНК-рекомбинантные, полученные с помощью методик генной инженерии. Эти методики заставляют вырабатывать антигены, необходимые для развития иммунитета, не самих микробов, вызывающих заболевание, а других, неопасных для человека. Примером могут служить вакцины против гриппа и гепатита В.
Иммунитет после введения инактивированных вакцин менее стойкий, чем от введения живых, и требует повторных прививок – ревакцинаций.
Отдельно надо сказать об анатоксинах. Это ядовитые вещества, которые возбудители заболеваний вырабатывают в процессе жизни. Их выделяют, очищают, обрабатывают определенным образом для снижения ядовитых свойств и также используют для прививок. Существует столбнячный анатоксин, коклюшный, дифтерийный. Использование анатоксинов вместо микробных тел и их частей позволяет уменьшить возможные осложнения и получить достаточно стойкий иммунитет.
Вакцины могут выпускаться в виде монопрепаратов (содержат только один вид возбудителей — против гриппа, кори, полиомиелита), реже – комплексных вакцин. К комплексным относятся вакцины АКДС, АДС, Бубо-кок, Тетракок, Петаксим.
Говорить о том, какие вакцины – живые или убитые, комплексные или монокомпонентные – тяжелее переносятся, более опасны, более вредны или, наоборот, полезны, довольно сложно. Это зависит не только от вакцин, но и от индивидуальных особенностей организма каждого конкретного человека.
Все вакцины в обязательном порядке проверяют на безвредность для людей. Такую проверку проводят в отделах бактериологического контроля на производствах и в Государственном научно-исследовательском институте стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича.
Прививать или не прививать своего ребенка, вводить ли вакцину себе – каждый решает сам. Надеюсь, что эта статья помогла вам узнать чуть больше о применяемых в современной медицине вакцинах.
При копировании обязательна активная ссылка на оригинал https://lady.webnice.ru/beauty/?act=article&v=311