Комы являются острыми осложнениями сахарного диабета (СД) и часто приводят к летальным исходам. Это прямой результат изменений содержания глюкозы в крови в виде гипергликемии или гипогликемии и сопутствующими метаболическими нарушениями. Если не произвести коррекцию, то гипергликемия может привести к диабетическому кетоацидозу (ДКА) или некетоновой гиперосмолярной коме. Они характеризуются разными степенями инсулиновой недостаточности, избыточной продукцией контринсулиновых гормонов и обезвоживанием. В некоторых случаях признаки диабетического кетоацидоза и гиперосмолярной комы могут развиваться одновременно.
Гипогликемия связана с нарушением равновесия между лекарственным средством, применяемым в лечении диабета (инсулин или таблетированные сахороснижающие средства), и приемом пищи или физической нагрузкой. Резкое падение концентрации глюкозы приводит к потере сознания, так как нормальное функционирование головного мозга почти полностью зависит от глюкозы. У больных сахарным диабетом могут развиться следующие коматозные состояния, непосредственно связанные и специфически обусловленные основным заболеванием, – кетоацидотическая, гиперосмолярная и гипогликемическая.
Быстрота и своевременность оказания помощи больным в коматозном состоянии во многом определяют прогноз. Поэтому с этих позиций правильное ведение пациентов на догоспитальном этапе представляется наиболее важным.
Гипогликемическая кома занимает третье место (5,4%) в структуре ком на догоспитальном этапе, а диабетическая (3%) – пятое (данные ННПОСМП).
Диабетическая кетоацидотическая кома
Диабетическая кетоацидотическая кома (ДКА) – грозное осложнение сахарного диабета, характеризующееся метаболическим ацидозом (рН меньше 7,35 или концентрация бикарбоната меньше 15 ммоль/л), увеличением анионной разницы, гипергликемией выше 14 ммоль/л, кетонемией. Чаще развивается при СД 1 типа. Частота от 5 до 20 случаев на 1000 больных в год (2/100). Смертность 5–15%, для больных старше 60 лет – 20%. От кетоацидотической комы погибает более 16% пациентов с СД 1 типа. Причина развития ДКА – абсолютный или резко выраженный относительный дефицит инсулина вследствие неадекватной инсулиновой терапии или повышения потребности в инсулине.
Провоцирующие факторы:
- Недостаточная доза инсулина или пропуск инъекции инсулина (или приема таблетированных сахароснижающих средств).
- Самовольная отмена сахароснижающей терапии.
- Нарушение техники введения инсулина.
- Присоединение других заболеваний (инфекции, травма, операции, беременность, инфаркт миокарда, инсульт, стресс и др.).
- Нарушения в диете (слишком большое количество углеводов).
- Физическая нагрузка при высокой гликемии.
- Злоупотребление алкоголем.
- Недостаточное проведение самоконтроля обмена веществ.
- Прием некоторых лекарственных препаратов (кортикостероиды, оральные контрацептивы, тиреоидные гормоны, кальцитонин, салуретики, этакриновая кислота, ацетазоламид, b-блокаторы, дилтиазем, адреналин, добутамин, диазоксид, никотиновая кислота, изониазид, аспарагиназа, циклофосфамид, дифенин, морфин, лития карбонат и др.).
Часто этиология ДКА остается неизвестной. Следует помнить, что до 25% случаев ДКА отмечается у пациентов с вновь выявленным сахарным диабетом.
Клиническая картина и классификация
Различают три стадии диабетического кетоацидоза (табл. 1):

1. Умеренный кетоацидоз.
2. Прекома, или декомпенсированный кетоацидоз.
3. Кома.
Осложнения кетоацидотической комы – тромбозы глубоких вен, легочная эмболия, артериальные тромбозы (инфаркт миокарда, инфаркт мозга, некрозы), аспирационная пневмония, отек мозга, отек легких, инфекции, редко – ЖКК и ишемический колит, эрозивный гастрит, поздняя гипогликемия. Отмечается тяжелая дыхательная недостаточность, олигурия и почечная недостаточность. Осложнения терапии – отек мозга и легких, гипогликемия, гипокалиемия, гипонатриемия, гипофосфатемия.
Диагностические критерии
1. Особенность ДКА – постепенное развитие, обычно на протяжении нескольких суток.
2. Наличие симптомов кетоацидоза (запах ацетона в выдыхаемом воздухе, дыхание Куссмауля, тошнота, рвота, анорексия, боли в животе).
3. Наличие симптомов дегидратации (снижение тургора тканей, тонуса глазных яблок, мышечного тонуса, сухожильных рефлексов, температуры тела и АД).
Следует помнить, что при СД 2 типа всегда надо искать интеркуррентное заболевание, как причину декомпенсации СД.
Перечень вопросов, обязательных при диагностике ДКА на догоспитальном этапе:
– страдает ли пациент сахарным диабетом?
– была ли ДКА в анамнезе?
– получает ли пациент сахароснижающую терапию, какую, последний прием препарата?
– когда был последний прием пищи или неадекватный прием пищи или ее пропуск?
– была ли слишком тяжелая физическая нагрузка или прием алкоголя?
– какие недавно перенесенные заболевания предшествовали коме (инфекционные заболевания)?
– Была ли полиурия, полидипсия и слабость?
Возможные ошибки терапии и диагностики на догоспитальном этапе:
1. Инсулинотерапия на догоспитальном этапе без возможности определения уровня гликемии и ее контроля.
2. Акцент в лечении на интенсивную инсулинотерапию при отсутствии эффективной регидратации.
3. Введение недостаточного объема жидкостей.
4. Введение гипотонических растворов, особенно в начале лечения. Это может привести к отеку головного мозга и к внутрисосудистому гемолизу.
5. Применение форсированного диуреза вместо регидратации. Применение диуретиков одновременно с введением жидкостей только замедлит восстановление водного баланса, а при гиперосмолярной коме назначение мочегонных средств категорически противопаказано.
6. Начало терапии с введения бикарбоната натрия может привести к смерти больного. Доказано, что адекватная инсулинотерапия в большинстве случаев помогает устранить ацидоз. Коррекция ацидоза бикарбонатом натрия сопряжена с исключительно большим риском осложнений. Введение щелочей усиливает гипокалиемию, нарушает диссоциацию оксигемоглобина; углекислота, образующаяся при введении бикарбоната, усиливает внутриклеточный ацидоз (хотя рН крови при этом может повышаться); парадоксальный ацидоз наблюдается и в спинномозговой жидкости, что может способствовать отеку мозга; не исключено развитие «рикошетного» алкалоза. Быстрое введение бикарбоната натрия (струйное) может вызвать смерть в результате быстрого развития гипокалиемии.
7. Введение раствора бикарбоната натрия без дополнительного введения препаратов калия, что обусловливает резко выраженную гипокалиемию, которая и становится причиной смерти больных.
8. Отмена или неназначение инсулина при ДКА больному, который не в состоянии принимать пищу.
9. Подкожное введение инсулина больным в диабетической коме, у которых всасывание инсулина нарушено вследствие нарушения микроциркуляции.
10. Внутривенно струйное введение инсулина. Период полураспада инсулина при внутривенном введении составляет 3–5 мин, и лишь первые 15–20 мин концентрация его в крови поддерживается на достаточном уровне, и поэтому такой путь введения неэффективен.
11. 3–4–х–кратное назначение инсулина короткого действия (ИКД) подкожно (на начальных этапах ДКА, когда состояние средней тяжести и нет потери сознания, возможно назначение инсулина подкожно). Эффективная продолжительность действия ИКД составляет 4–5 ч, особенно в условиях кетоацидоза. Поэтому ИКД надо назначать не менее 5–6 раз в сутки без ночного перерыва.
12. Применение для борьбы с коллапсом симпатотонических препаратов. Они, во–первых, являются контринсулиновыми гормонами и, во–вторых, у больных диабетом их стимулирующее влияние на секрецию глюкагона выражено значительно сильнее, чем у здоровых лиц.
13. Неправильная диагностика ДКА. При ДКА нередко встречается так называемый «диабетический псевдоперитонит», который симулирует симптомы «острого живота» – напряжение и болезненность брюшной стенки, уменьшение или исчезновение перистальтических шумов, иногда повышение сывороточной амилазы. Одновременное обнаружение лейкоцитоза может навести на ошибочный диагноз и больной попадает в инфекционное («кишечная инфекция») или хирургическое («острый живот») отделения. Во всех случаях «острого живота» или диспепсических явлений у больного сахарным диабетом необходимо определение гликемии и ке тонурии.
14. Неизмерение гликемии любому больному, находящемуся в бессознательном состоянии, нередко приводит к постановке ошибочных диагнозов – «нарушение мозгового кровообращения», «кома неясной этиологии», в то время как у пациента имеется острая диабетическая декомпенсация обмена веществ.
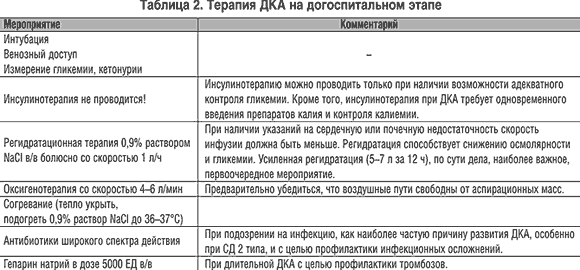
Терапия на догоспитальном этапе представлена в таблице 2.
Гиперосмолярная кетоацидотическая кома
Гиперосмолярная кетоацидотическая кома характеризуется выраженной дегидратацией, значительной гипергликемией (часто выше 33 ммоль/л), гиперосмолярностью (более 340 мосм/л), гипернатриемией выше 150 ммоль/л, отличающееся отсутствием кетоацидоза (максимальная кетонурия (+)). Чаще развивается у пожилых больных СД 2 типа. Встречается в 10 раз реже, чем ДКА. Характеризуется более высокой летальностью (15–60%). Причина развития гиперосмолярной комы – относительный дефицит инсулина и факторы, сопровождающиеся дегидратацией.
Гиперосмолярная кетоацидотическая кома характеризуется выраженной дегидратацией, значительной гипергликемией (часто выше 33 ммоль/л), гиперосмолярностью (более 340 мосм/л), гипернатриемией выше 150 ммоль/л, отличающееся отсутствием кетоацидоза (максимальная кетонурия (+)). Чаще развивается у пожилых больных СД 2 типа. Встречается в 10 раз реже, чем ДКА. Характеризуется более высокой летальностью (15–60%). Причина развития гиперосмолярной комы – относительный дефицит инсулина и факторы, сопровождающиеся дегидратацией.
Провоцирующие факторы:
- недостаточная доза инсулина или пропуск иньекции инсулина (или приема таблетированных сахароснижающих средств);
- самовольная отмена сахароснижающей терапии;
- нарушение техники введения инсулина;
- присоединение других заболеваний (инфекции, острый панкреатит, травма, операции, беременность, инфаркт миокарда, инсульт, стресс и др.);
- нарушения в диете (слишком большое количество углеводов);
- прием некоторых лекарственных препаратов (диуретики, кортикостероиды, b-блокаторы и др.);
- охлаждение;
- невозможность утолить жажду;
- ожоги;
- рвота или диарея;
- гемодиализ или перитонеальный диализ.
Следует помнить, что одна треть пациентов с гиперосмолярной комой не имеет предшествующего диагноза сахарного диабета.
Клиническая картина
Нарастающая в течение нескольких дней или недель сильная жажда, полиурия, выраженная дегидратация, артериальная гипотония, тахикардия, фокальные или генерализованные судороги. Если при ДКА расстройства функции ЦНС и периферической нервной системы протекают по типу постепенного угасания сознания и угнетения сухожильных рефлексов, то гиперосмолярная кома сопровождается разнообразными психическими и неврологическими нарушениями. Кроме сопорозного состояния, также нередко отмечаемого при гиперосмолярной коме, психические нарушения часто протекают по типу делирия, острого галлюцинаторного психоза, катотонического синдрома. Неврологические нарушения проявляются очаговой неврологической симптоматикой (афазией, гемипарезом, тетрапарезом, полиморфными сенсорными нарушениями, патологическими сухожильными рефлексами и т. д.).
Диагностические критерии
1. Развивается более медленно (в течение 5–14 дней), чем ДКА.
Более выраженная дегидратация (снижение тургора тканей, тонуса глазных яблок, мышечного тонуса, сухожильных рефлексов, температуры тела и АД).
2. Часто полиморфная неврологическая симптоматика, исчезающая при купировании гиперосмолярной комы.
3. Отсутствие кетоацидоза (запаха ацетона в выдыхаемом воздухе, отсутствие дыхания Куссмауля, тошноты, рвоты, анорексии, болей в животе).
4. Отсутствие или невыраженная кетонурия.
5. Раньше возникает анурия и азотемия.
6. Пожилой и старческий возраст.
Среди возможных ошибок в терапии и диагностике выделяются:
1. Введение гипотонических растворов на догоспитальном этапе.
2. Длительное введение гипотонических растворов.
3. Гиперосмолярный синдром нередко ошибочно расценивается, как реактивный психоз, цереброваскулярный пароксизм или другое острое психическое или неврологическое заболевание.
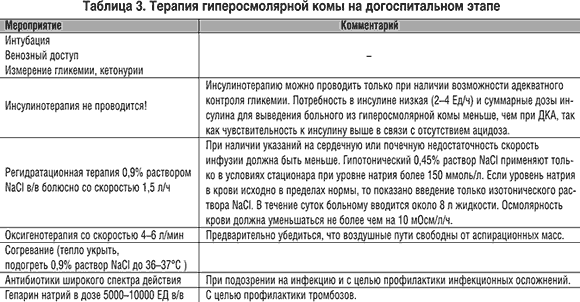
Терапия рассмотрена в таблице 3.
Гипогликемическая кома
Гипогликемическая кома развивается вследствие резкого снижения уровня глюкозы в крови (ниже 3–3,5 ммоль/л) и выраженного энергетического дефицита в головном мозге.
Гипогликемическая кома развивается вследствие резкого снижения уровня глюкозы в крови (ниже 3–3,5 ммоль/л) и выраженного энергетического дефицита в головном мозге.
Провоцирующие факторы:
– передозировка инсулина
– пропуск или неадекватный прием пищи
– повышенная физическая нагрузка
– избыточный прием алкоголя
– прием лекарственных средств (b-блокаторы, салицилаты, сульфаниламиды, фенилбутазон, анаболические стероиды, препараты кальция, тетрациклин, литий карбонат, пиридоксин, ингибиторы MAO, клофибрат).
Клиническая картина
Симптомы гипогликемии делятся на ранние (холодный пот, особенно на лбу, бледность кожи, сильный приступообразный голод, дрожь в руках, раздражительность, слабость, головная боль, головокружение, онемение губ), промежуточные (неадекватное поведение, агрессивность, сердцебиение, плохая координация движений, двоение в глазах, спутанность сознания) и поздние (потеря сознания, судороги).
Диагностические критерии
1. Внезапное развитие, обычно на протяжении нескольких минут, реже часов.
2. Наличие характерных симптомов гипогликемии.
3. Гликемия ниже 3–3,5 ммоль/л.
Следует помнить, что отсутствие симптомов не исключает гипогликемии и у пациентов с сахарным диабетом симптомы гипогликемии могут быть при нормальной концентрации глюкозы в крови.
Стандартные вопросы врача на догоспитальном этапе:
– страдает ли пациент сахарным диабетом, его продолжительность;
– получает ли сахароснижающую терапию (какую, последний прием препарата);
– неадекватный прием пищи или ее пропуск, последний прием пищи;
– любые эпизоды гипогликемии в прошлом;
– слишком тяжелая физическая нагрузка;
– прием чрезмерного количества алкоголя.
Следует помнить – самой частой причиной потери сознания при сахарном диабете 1 типа является тяжелая гипогликемия.
После выведения больного из гипогликемической комы рекомендуется применять средства, улучшающие микроциркуляцию и метаболизм в клетках головного мозга в течение 3–6 недель. Повторные гипогликемии могут привести к поражению головного мозга.
Возможные ошибки диагностики и терапии:
1. Попытка ввести углевод–содержащие продукты (сахар и т.п.) в ротовую полость пациенту без сознания. Это часто приводит к аспирации и к асфиксии.
2. Применение для купирования гипогликемии непригодных для этого продуктов (хлеб, шоколад и т.п.). Эти продукты не обладают достаточным сахароповышающим действием или повышают сахар крови, но слишком медленно.
3. Неправильная диагностика гипогликемии. Часть симптомов гипогликемии может имитировать эпилептический припадок, инсульт, «вегетативный криз» и др. У больного, получающего сахароснижающую терапию, практически при любом неясном пароксизмальном состоянии целесообразно экстренно определить сахар крови. При отсутствии возможности определения уровня гликемии или относительно медленном выполнении этого анализа экспресс–лабораториями (30–40 мин), при обоснованном подозрении на гипогликемию ее купирование следует начинать сразу же, еще до получения ответа лаборатории.
4. Часто не учитывают опасность рецидива после выведения из тяжелой гипогликемии. При передозировке препаратов инсулина продленного действия и препаратов сульфонилмочевины гипогликемия может повториться и поэтому больной требует интенсивного наблюдения, контроля уровня гликемии и при необходимости ее коррекции в течение нескольких суток.
Терапия гипогликемической комы представлена в таблице 4. Дифференциально–диагностические критерии коматозных состояний при СД представлены в таблице 5.


Заключение
У пациентов, находящихся в коматозном состоянии неизвестного генеза, всегда необходимо исследовать гликемию. Если достоверно известно, что у пациента сахарный диабет и в то же время трудно дифференцировать гипо– или гипергликемический генез коматозного состояния, рекомендуется внутривенно струйное введение глюкозы в дозе 20–40–60 мл 40% раствора в целях дифференциальной диагностики и оказания экстренной помощи при гипогликемической коме. В случае гипогликемии это значительно улучшит симптоматику и таким образом позволит дифференцировать эти два состояния. В случае гипергликемической комы такое количество глюкозы на состоянии пациента практически не скажется.
У пациентов, находящихся в коматозном состоянии неизвестного генеза, всегда необходимо исследовать гликемию. Если достоверно известно, что у пациента сахарный диабет и в то же время трудно дифференцировать гипо– или гипергликемический генез коматозного состояния, рекомендуется внутривенно струйное введение глюкозы в дозе 20–40–60 мл 40% раствора в целях дифференциальной диагностики и оказания экстренной помощи при гипогликемической коме. В случае гипогликемии это значительно улучшит симптоматику и таким образом позволит дифференцировать эти два состояния. В случае гипергликемической комы такое количество глюкозы на состоянии пациента практически не скажется.
Во всех случаях, когда невозможно измерение гликемии немедленно эмпирически надо ввести высококонцентрированную глюкозу. Эстренно некупированная гипогликемия может быть смертельна.
Базисными препаратами для пациентов в коме при отсутствии возможности уточнения диагноза и скорой госпитализации считаются тиамин 100 мг в/в, глюкоза 40% 60 мл и налоксон 0,4–2 мг в/в. Эта комбинация эффективна и безопасна во многих случаях.
Диабетический кетоацидоз – декомпенсированная форма сахарного диабета, протекающая с повышением уровня глюкозы и кетоновых тел в крови.
Является одним из самых часто встречаемых в эндокринологии осложнений сахарного диабета (СД). Регистрируется примерно в 5-8 случаях на 1000 пациентов с СД 1 типа в год, напрямую связан с качеством оказания медицинской помощи больным сахарным диабетом. Смертность от кетоацидотической комы колеблется в пределах 0,5-5% и зависит от современности госпитализации пациента в стационар. В основном данное осложнение встречается у людей до 30 лет.
Причины диабетического кетоацидоза
Причиной развития острой декомпенсации выступает абсолютная (при сахарном диабете 1 типа) или выраженная относительная (при сахарном диабете 2 типа) инсулиновая недостаточность. Кетоацидоз может являться одним из вариантов манифестации СД 1 типа у пациентов, не знающих о своем диагнозе и не получающих терапию. Если больной уже получает лечение по поводу СД, причинами для развития кетоацидоза могут стать:
- Неадекватная терапия. Включает случаи неправильного подбора оптимальной дозировки инсулина, несвоевременного перевода пациента с таблетированных сахароснижающих препаратов на инъекции гормона, неисправность инсулиновой помпы или шприц-ручки.
- Несоблюдение рекомендаций врача. Диабетический кетоацидоз может возникать, если пациент неправильно корректирует дозировку инсулина в зависимости от уровня гликемии. Патология развивается при использовании просроченных препаратов, утративших свои лечебные свойства, самостоятельном снижении дозировки, самовольной замене инъекций таблетками или полном отказе от сахароснижающей терапии.
- Резкое возрастание потребности в инсулине. Обычно сопровождает такие состояния, как беременность, стресс (особенно у подростков), травмы, инфекционные и воспалительные заболевания, инфаркты и инсульты, сопутствующие патологии эндокринного происхождения (акромегалия, синдром Кушинга и др.), хирургические вмешательства. Причиной кетоацидоза может быть использование некоторых медикаментов, из-за которых возрастает уровень глюкозы в крови (например, глюкокортикостероидов).
Классификация
По тяжести течения диабетический кетоацидоз разделяют на три степени:
- Легкая степень. Глюкоза плазмы 13-15 ммоль/л, pH артериальной крови в пределах от 7,25 до 7,3. Сывороточный бикарбонат от 15 до 18 мэкв/л. Наличие кетоновых тел при анализе мочи и сыворотки крови +. Анионная разница выше 10. Нарушений сознания нет.
- Средняя степень. Глюкоза плазмы в пределах 16-19 ммоль/л. Диапазон кислотности артериальной крови от 7,0 до 7,24. Сывороточный бикарбонат — 10-15 мэкв/л. Кетоновые тела в моче, сыворотке крови ++. Нарушения сознания отсутствуют или отмечается сонливость. Анионная разница более 12.
- Тяжелая степень. Глюкоза плазмы выше 20 ммоль/л. Показатель кислотности артериальной крови менее 7,0. Сывороточный бикарбонат менее 10 мэкв/л. Кетоновые тела в моче и сыворотке крови +++. Анионная разница превышает 14. Есть нарушения сознания в виде сопора или комы.
Симптомы диабетического кетоацидоза
Для ДКА не характерно внезапное развитие. Симптомы патологии обычно формируются в течение нескольких суток, в исключительных случаях возможно их развитие в период до 24 часов. Кетоацидоз при диабете проходит стадии прекомы, начинающейся кетоацидотической комы и полной кетоацидотической комы.
Первыми жалобами пациента, свидетельствующими о состоянии прекомы, являются неутолимая жажда, частое мочеиспускание. Больного беспокоит сухость кожных покровов, их шелушение, неприятное чувство стянутости кожи. При пересыхании слизистых оболочек появляются жалобы на жжение и зуд в носу. Если кетоацидоз формируется в течение длительного времени, возможна сильная потеря веса. Слабость, усталость, потеря работоспособности и аппетита являются характерными жалобами для пациентов, находящихся в состоянии прекомы.
Начинающаяся кетоацидотическая кома сопровождается тошнотой и приступами рвоты, которые не приносят облегчения. Возможно появление болей в животе (псевдоперитонит). Головная боль, раздражительность, сонливость, заторможенность свидетельствуют о вовлечении в патологический процесс ЦНС. Осмотр пациента позволяет установить наличие ацетонового запаха из ротовой полости и специфического дыхательного ритма (дыхание Куссмауля). Отмечаются тахикардия и артериальная гипотензия. Полной кетоацидотической коме сопутствуют утрата сознания, снижение или полное отсутствие рефлексов, выраженная дегидратация.
Осложнения
Диабетический кетоацидоз может привести к развитию отека легких (в основном вследствие неправильно подобранной инфузионной терапии). Возможны артериальные тромбозы различной локализации в результате чрезмерной потери жидкости и повышения вязкости крови. В редких случаях развивается отек мозга (в основном встречается у детей, часто оканчивается летально). Из-за снижения объема циркулирующей крови формируются шоковые реакции. При длительном нахождении в коме нельзя исключать присоединение вторичной инфекции, чаще всего в виде пневмонии.
Диагностика
Диагностика кетоацидоза при СД может представлять сложности. Пациенты с симптомами перитонита, тошнотой и рвотой часто попадают не в эндокринологические, а в хирургические отделения. Чтобы избежать непрофильной госпитализации пациента, проводятся следующие диагностические мероприятия:
- Консультация эндокринолога или диабетолога. На приеме специалист оценивает общее состояние пациента, если сознание сохранено, уточняет жалобы. Первичный осмотр дает информацию о дегидратации кожных покровов и видимых слизистых, снижении тургора мягких тканей, наличии абдоминального синдрома. При осмотре выявляется гипотония, признаки нарушения сознания (сонливость, заторможенность, жалобы на головные боли), запах ацетона, дыхание Куссмауля.
- Лабораторные исследования. При кетоацидозе концентрация глюкозы в кровяной плазме выше 13 ммоль/л. В моче пациента определяется наличие кетоновых тел и глюкозурия (диагностика проводится с использованием специальных тестовых полосок). При исследовании крови выявляется понижение кислотного показателя (менее 7,25), гипонатриемия (менее 135 ммоль/л) и гипокалиемия (менее 3,5 ммоль/л), гиперхолестеринемия (более 5,2 ммоль/л), повышение осмолярности плазмы (более 300 мосм/кг), повышение анионной разницы.
ЭКГ важна для исключения инфаркта миокарда, к которому могут приводить электролитные нарушения. Рентгенография грудной клетки необходима для исключения вторичного инфекционного поражения дыхательных путей. Дифференциальную диагностику диабетической кетоацидотической комы проводят с молочнокислой комой, гипогликемической комой, уремией. Дифдиагностика с гиперосмолярной комой редко имеет клиническое значение, так как принципы лечения пациентов сходны. Если быстрое установление причины потери сознания у больных с сахарным диабетом невозможно, рекомендуется введение глюкозы, чтобы купировать гипогликемию, которая встречается гораздо чаще. Быстрое улучшение или ухудшение состояния человека на фоне введения глюкозы позволяет установить причину потери сознания.
Лечение диабетического кетоацидоза
Лечение кетоацидотического состояния проводится только в условиях стационара, при развитии комы — в условиях палаты интенсивной терапии. Рекомендован постельный режим. Терапия состоит из следующих составляющих:
- Инсулинотерапия. Обязательна коррекция дозы гормона или подбор оптимальной дозировки при первично выявленном сахарном диабете. Лечение должно сопровождаться постоянным контролем уровня гликемии и кетонемии.
- Инфузионная терапия. Проводится по трем основным направлениям: регидратация, коррекция КОС и электролитных нарушений. Используют внутривенное введение хлорида натрия, препаратов калия, гидрокарбоната натрия. Рекомендуется раннее начало. Количество вводимого раствора рассчитывается с учетом возраста и общего состояния больного.
- Лечение сопутствующих патологий. Усугублять состояние пациента с ДКА могут сопутствующие инфаркт, инсульт, инфекционные заболевания. Для лечения инфекционных осложнений показана антибиотикотерапия, при подозрении на сосудистые катастрофы – тромболитическая терапия.
- Мониторинг жизненно-важных показателей. Осуществляется постоянная электрокардиография, пульсоксиметрия, оценка уровня глюкозы и кетоновых тел. Первоначально мониторинг проводят каждые 30-60 минут, а после улучшения состояния пациента каждые 2-4 часа в течение последующих суток.
Прогноз и профилактика
При своевременной и эффективной терапии в условиях стационара кетоацидоз удается купировать, прогноз благоприятный. При задержке оказания медицинской помощи патология быстро переходит в кому. Летальность составляет 5%, а у пациентов в возрасте старше 60 лет — до 20%.
Основа профилактики кетоацидоза – это обучение пациентов, страдающих от сахарного диабета. Больные должны быть ознакомлены с симптоматикой осложнения, информированы о необходимости правильного использования инсулина и приборов для его введения, обучены основам контроля над уровнем глюкозы в крови. Человек должен быть максимально осведомлен о своем заболевании. Рекомендуется ведение здорового образа жизни и соблюдение диеты, подобранной эндокринологом. Если развивается симптоматика, присущая диабетическому кетоацидозу, необходимо обратиться к врачам, чтобы избежать негативных последствий.
Врач реаниматолог отделения АиР
Еще фото
Автор (ы): О. О. Смирнова, к. б. н., ветеринарный врач-терапевт, Ветеринарная клиника неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург / О. Smirnova, Phd, DVM, Veterinary clinic of neurology, traumatology and intensive therapy, Saint-Petersburg
Журнал: №3 — 2015
УДК 616.379-008.64:619
Ключевые слова: сахарный диабет, дегидратация, ацидоз, электролитные нарушения, инсулинотерапия
Key words: diabetes, dehydration, acidosis, electrolyte disturbances, insulin therapy
Сокращения: ГК – глюкоза крови, ДКА – диабетический кетоацидоз, ЖКТ – желудочно-кишечный тракт, ОРИТ – отделение реанимации и интенсивной терапии, ОЦК – объём циркулирующей крови, СД – сахарный диабет, СКФ – скорость клубочковой фильтрации, СЖК – свободные жирные кислоты, СТГ – соматотропный гормон, ХБП – хроническая болезнь почек, Ca – кальций, К – калий, Na – натрий, P – фосфор
Аннотация
ДКА – это неотложное состояние пациентов, возможное и у собак, и у кошек, и требующее моментальной диагностики и незамедлительного лечения в ОРИТ. ДКА характеризуется гипергликемией, метаболическим ацидозом, потерей электролитов, кетонемией и обезвоживанием . Усиленная выработка кетоновых тел является результатом дефицита инсулина, инсулинорезистентности и повышенной выработки диабетогенных гормонов, преимущественно глюкагона. Данные, полученные после изучения анамнеза и проведения физикального осмотра, могут сильно варьировать от пациента к пациенту из-за быстро прогрессирующего характера ДКА и того, что в различных клинических случаях проходит разное количество времени между возникновением ДКА и моментом, когда владелец замечает симптомы заболевания . Крайне важная задача врача-терапевта в такой ситуации – вовремя распознать признаки основного заболевания, что станет залогом оказания своевременной и грамотной помощи пациенту.
Сахарный диабет – это болезнь, характеризующаяся абсолютным или относительным недостатком инсулина. При этой патологии дефицит инсулина наряду с аномально высокой секрецией глюкагона ответствен за развитие гипергликемии натощак. При незначительном дефиците инсулина нарушение транспорта глюкозы в ткани вызывает слабую/умеренную степень гипергликемии. При сильном дефиците инсулина отмечено не только отсутствие потребления глюкозы тканями, но и перепродукция глюкозы и избыточная мобилизация запасов жира и белков организма. При явном отсутствии инсулина повышенная поставка жирных кислот в печень ведёт также к продукции кетоновых тел, ответственных за клинический статус развития кетоацидоза .
ДКА может развиться у кошек и собак, несмотря на ежедневные инъекции инсулина в ходе лечения СД в том случае, когда не достигается оптимальная цель инсулинотерапии. Пациенты, страдающие ДКА – это пациенты, больные СД, которых можно отнести к группе нестабильных пациентов-диабетиков . Термин «осложненный сахарный диабет» часто применяют, когда идет речь о развитии кетоацидоза .
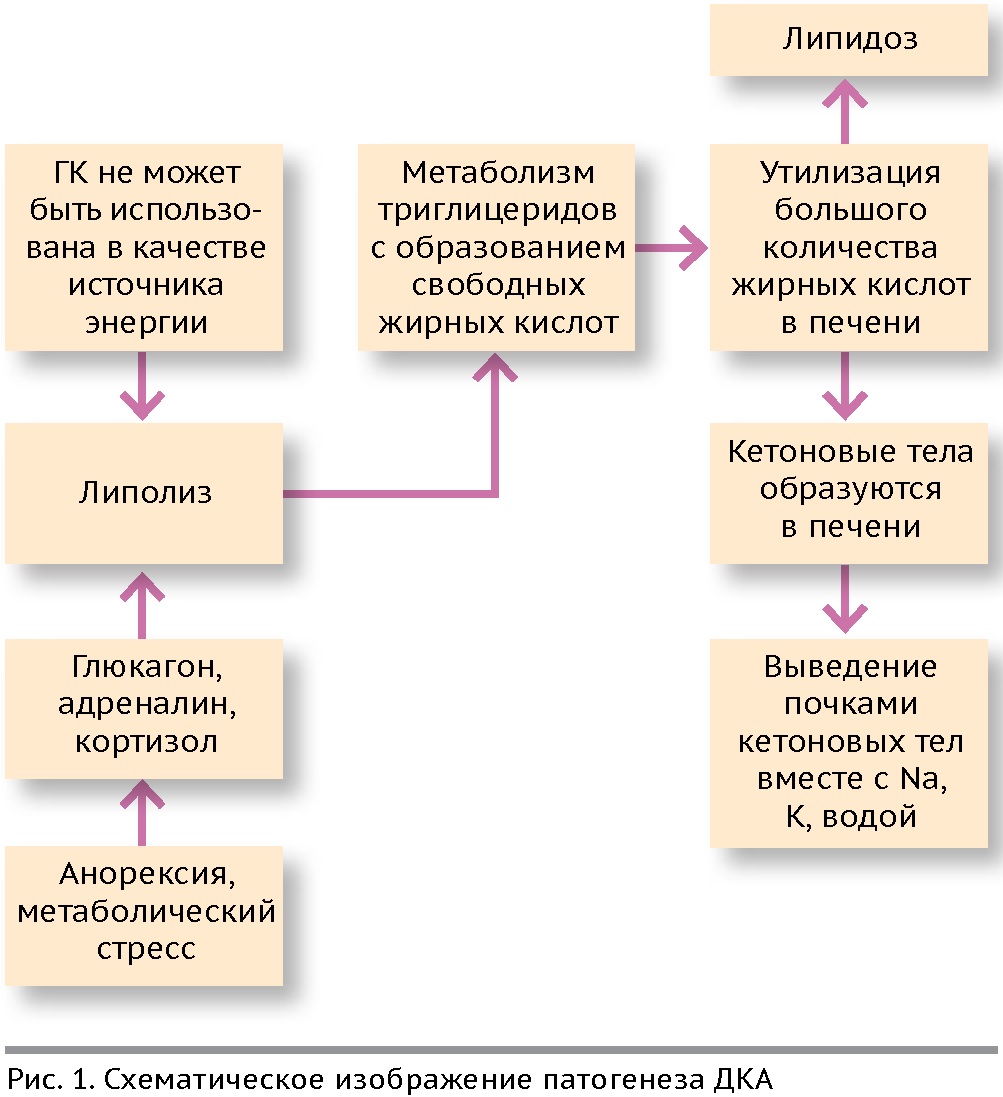
Патогенез ДКА
Инсулин – это единственный в своём роде анаболический гормон, который осуществляет транспорт глюкозы из крови в клетку. Абсолютный и относительный дефицит инсулина в случае заболевания СД приводит к неспособности клеток утилизировать глюкозу и, соответственно, к внеклеточной гипергликемии .
Сахарный диабет интерпретируется физиологически как состояние голода. Поскольку клетки, несмотря на внеклеточную гипергликемию, находятся в состоянии гипогликемии, при СД с целью получения энергии активируется продукция и использование СЖК. Кетоны могут быть использованы в качестве источника энергии во многих тканях . Дефицит инсулина оказывает стимулирующее действие на липолиз. Это увеличивает доступность СЖК в печени и способствует кетогенезу, ведь для синтеза кетоновых тел (ацетоуксусной кислоты, β-гидроксимасляной кислоты и ацетона) требуется именно активация процесса образования СЖК из триглицеридов, хранящихся в подкожной жировой клетчатке. В печени при этом происходит «сдвиг» обмена веществ от синтеза жиров к их окислению .
В ходе метаболизма СЖК образуется ацетоацетилкоэнзима А, он, в свою очередь, преобразуется в ацетилкоэнзим А для использования в цикле Кребса. Если в печени имеется избыток СЖК, то избыток ацетоацетилкоэнзима А также способен метаболизироваться с образованием кетонов (ацетоацетата, ацетона и b-OH-бутирата) . Эти кетоновые тела и являются субстратами для метаболизма энергии большинством тканей. Образование кетонов в печени связано с производством эквивалентного количества ионов водорода, которое влияет на концентрацию бикарбоната в плазме. Кетоны продолжают накапливаться в крови, буферная система организма становится перегружена, что приводит к увеличению концентрации ионов водорода, уменьшению бикарбоната сыворотки и развитию метаболического ацидоза .
Кетоны относительно медленно метаболизируются печенью, но при этом достаточно быстро экскретируются почками. Тем не менее, повышение уровня кетонов в крови в конечном итоге превосходит почечный порог для полной реабсорбции. Их выведение с мочой индуцирует осмотический диурез . Патологическое состояние «кетоз» начинается тогда, когда продукция кетонов превышает потребности организма в энергии и значительную буферную емкость. В результате последующих приступов рвоты, диареи в комбинации с отсутствием приема жидкости метаболический ацидоз ухудшается .
Но дефицит инсулина не может быть единственной патофизиологической причиной развития ДКА. Важно отметить, что этот метаболический путь стимулируется антагонистами инсулина: глюкагоном, кортизолом, СТГ и адреналином и относительно быстро инактивируется инсулином. Глюкагон считается наиболее «влиятельным» кетогенным гормоном. Глюкагон может непосредственно влиять на печеночный кетогенез. Низкое отношение инсулин-глюкагон имеет прямое влияние на печень, что способствует увеличению производства кетонов. Но кетогенез может возникнуть и при отсутствии глюкагона. Катехоламины являются также важными модуляторами кетогенеза, в первую очередь, за счет стимуляции липолиза. Кортизол и СТГ усиливают липолиз в присутствии относительного или абсолютного дефицита инсулина, блокируют действие инсулина в периферических тканях и усиливают стимулирующий эффект адреналина и глюкагона в печени на продукцию глюкозы .
Также в крови таких пациентов отмечается повышение провоспалительных цитокинов (например, фактор некроза опухоли – альфа, интерлейкина-6). Инсулин является достаточно мощным ингибитором и липолиза, и окисления СЖК . Кроме того, стресс-гормоны стимулируют печеночную продукцию глюкозы через активацию гликогенолиза и глюконеогенеза и подавляют инсулин-опосредованное поглощение глюкозы в мышцы . Стимуляция липолиза, кетогенеза и глюконеогенеза, в свою очередь, усугубляет гипергликемию и способствует кетонемии .
Сочетание инсулиновой недостаточности и избытка контринсулярных гормонов стимулирует катаболизм белка. Увеличение концентрации аминокислот в плазме ухудшает действие инсулина в мышцах и обеспечивает субстрат для глюконеогенеза .
Схематически и кратко патогенез ДКА изображен на рисунке №1. Этот патологический путь может стимулироваться стрессовым состоянием. В качестве такого стресса способно выступать другое заболевание, так как в организме повышается производство кон- тринсулярных гормонов в ответ на широкий спектр заболеваний . Наиболее распространёнными патологиями, играющими роль «стресс-состояний», являются панкреатит, пиометра, инфекционные болезни, спонтанный и ятрогенный гиперадренокортицизм, эструс, беременность, акромегалия . Например, инфекция вызывает заметное увеличение секреции кортизола и глюкагона; сердечная недостаточность и травма – глюкагона и катехоламинов; лихорадка индуцирует секрецию глюкагона, СТГ, катехоламинов и кортизола .
Способность поддерживать нормальный гомеостаз глюкозы представляет собой баланс между чувствительностью организма к инсулину и количеством инсулина, вырабатываемого бета-клетками или вводимого экзогенно . Антагонисты инсулина сопровождают в основном абсолютный дефицит инсулина. ДКА развивается наиболее часто у собак и кошек с ранее не диагностированным СД. Реже ДКА развивается при лечении инсулином больных диабетом пациентов, которые получают недостаточную дозу инсулина. Особенно это вероятно в сочетании с одновременными инфекционными, воспалительными или гормональными расстройствами. Поэтому у стабильных диабетиков, получающих адекватную инсулинотерапию, с развитием патологий-причин для инсулинорезистентности, потребность в инсулине может возрастать, а это ведет к предрасположенности развития ДКА. Эффект этих гормональных нарушений – провокация инсулиновой недостаточности за счет развития инсулинорезистентности, стимуляции липолиза, ведущего к кетогенезу, и стимуляции глюконеогенеза, усугубляющего гипергликемию. Все эти факторы приводят к возможному возникновению клинических проявлений, связанных с ДКА .
Диагностика
Диагностика ДКА чаще всего не представляет сложности. Это осложнение СД следует подозревать у любой собаки или кошки, которые демонстрируют в анамнезе характерные для СД клинические симптомы с последующим значительным ухудшением общего самочувствия . С другой стороны, пациенты в состоянии ДКА нередко поступают в ветеринарную клинику в очень тяжелой степени дегидратации и состоянии оглушения, ступора или комы. К сожалению, в подобных ситуациях не всегда есть достаточное количество времени для сбора полноценного анамнеза. Тем не менее, первое, что следует сделать после оказания первой помощи пациенту – это тщательно опросить владельца животного о возможных признаках СД. В условиях работы ветеринарной клиники, в которой есть четкое разделение специализаций врачей, безусловно, возможно совместить оказание первой помощи пациенту в условиях ОРИТ и сбор анамнеза жизни и болезни врачом-терапевтом.
Отмечено, что ДКА чаще страдают пожилые коты старше 8 лет и самки собак в возрасте 7-9 лет . ДКА должен подозреваться тогда, когда в анамнезе пациента отмечаются классические для СД признаки. К подобным признакам можно отнести полиурию, полидипсию, кахексию на фоне полифагии или нормофагии. Эти симптомы чаще всего проявляются на протяжении нескольких недель или месяцев и прогрессируют до появления признаков летаргии, анорексии и рвоты в течение нескольких дней до обследования. В таком случае жалобы владельцев описывают признаки постепенного ухудшения самочувствия пациента. Однако у некоторых пациентов отмечается острое начало признаков полидипсии, полиурии, рвоты, слабости и угнетения, в том числе – острое развитие катаракты у собак .
Увеличение ГК приводит к увеличению осмолярности плазмы в результате осмотического диуреза, вызывающего потери воды и солей. Увеличение осмолярности плазмы заставляет воду поступать из внутриклеточного пространства, что приводит к обезвоживанию и в конечном итоге – к развитию обнибуляции и комы . Поэтому при физикальном обследовании часто описывается средняя-тяжелая степень дегидратации, которая сопровождается характерными клиническими находками: потерей тургора кожи, запавшими глазными яблоками, липкими сухими слизистыми оболочками, нарушением периферического кровоснабжения, тахикардией, коллапсом, тахипноэ . При тяжёлом ацидозе может быть выявлено, напротив, медленное, глубокое дыхание Куссмауля . Также могут быть обнаружены симптомы осложнений сахарного диабета: диабетическая катаракта у собак, стопохождение в результате периферической нейропатии у кошек, артериальная гипертензия у обоих видов животных. Пальпация брюшной полости нередко выявляет гепатомегалию . Иногда анамнез и данные осмотра могут свидетельствовать о перенесенной недавно сопутствующей болезни, ставшей стрессовым «провокатором» активации контринсулярных гормонов. Например, характерными симптомами может проявляться акромегалия у кошек: увеличением длины нижней челюсти, увеличением в размерах лап, расширением межзубных пространств . Подобные симптомы – рвота и боли в животе – являются распространенными из-за часто встречающегося сопутствующего панкреатита .
Нервно-мышечная слабость у этих пациентов может быть обусловлена электролитными нарушениями: гипернатриемией, гиперкалиемией или гипокалиемией в зависимости от того, какое нарушение концентрации калия характерно для данного пациента. Пациента с гипернатриемией клинически характеризует мышечная слабость, тремор, кома, мышечная ригидность, судороги . Клинические признаки пациентов, страдающих нарушением концентрации калия в крови, ранее подробно рассматривались в статье «Изменения концентрации калия: что опаснее» (Vetpharma, 2014, №4).
Таким образом, обычно в начале развиваются классические клинические признаки диабета (например, полиурия, полидипсия, полифагия, потеря веса), за которыми по мере прогрессирования кетонемии и метаболического ацидоза следуют системные признаки заболевания (летаргия, анорексия, рвота, а иногда – и сильный запах ацетона при дыхании). Первичное заболевание, которое вызывает ДКА (например, панкреатит, инфекция, акромегалия), также вносит свой вклад в наблюдаемую клиническую картину. Промежуток времени между возникновением диабета и последующим развитием ДКА непредсказуем и колеблется от нескольких дней до нескольких месяцев. Но как только развивается кетоацидоз, тяжелое течение болезни становится очевидным в течение нескольких дней .
Лабораторная диагностика
Для разработки подходящего протокола лечения необходимо проведение группы чрезвычайно важных исследований, включая:
• общий анализ мочи,
• определение гематокрита,
• определение уровня общего белка в сыворотке крови,
• определение уровня ГК,
• определение общего уровня CO2 в венозной крови или исследование кислотно-щелочного равновесия в артериальной крови,
• исследование уровня мочевины или креатинина в крови,
• исследование электролитного баланса в крови (Na, K, Ca, PO4) .
Результаты рутинных лабораторных исследований обычно демонстрируют характерные изменения. При исследовании биохимического профиля сыворотки крови помимо гипергликемии нередко обнаруживают гиперхолестеролемию, повышенные концентрации ферментов печени (АЛТ, АСТ), гипофосфатемию, гипокалиемию . Содержание натрия у таких пациентов обычно пониженное-нормальное. У 25-30% кошек отмечают иктеричность сыворотки . Чрезмерное выведение жидкости и электролитов через почки в сочетании с обезвоживанием из-за рвоты приводит к сокращению объема жидкости в организме (включая осмолиты), недостаточному кровоснабжению тканей и развитию преренальной азотемии. Иногда также характерны изменения, связанные с сопутствующим панкреатитом .
Такие изменения, как гиперпротеинемия и преренальная азотемия обычно свидетельствуют о развитии гемоконцентрации. Прогрессирующая потеря электролитов и воды приводит к дальнейшему сокращению ОЦК, гипоперфузии тканей, снижению СКФ, и ухудшению преренальной азотемии и обезвоживанию. При понижении СКФ теряется способность к выделению глюкозы и, в меньшей степени, ионов водорода. Глюкоза и кетоны затем накапливаются в сосудистом пространства в более быстром темпе. В результате увеличивается гипергликемия и усиливается ацетонемический синдром и ухудшается метаболический ацидоз .
Признаки гемоконцентрации крайне важно интерпретировать правильно, так как это способно повлиять на прогностический критерий. Преренальная азотемия, сопровождающаяся повышением уровня мочевины и креатинина – купируемое состояние при правильном ведении инфузионной терапии, в отличие от ренальной азотемии, которая может свидетельствовать, например, о наличии диабетической нефропатии у кошек и о сопутствующей ХБП. В этом случае крайне важной задачей инфузионной терапии является восстановление почечного кровотока .
Важно также отметить, что электролитные нарушения являются очень частым осложнением ДКА. Поскольку и гипер-, и гипокалиемия способны представлять угрозу жизни пациента, крайне желательно иметь возможность определять концентрацию калия в клинических условиях быстро. Не менее актуален этот вопрос будет при проведении инсулинотерапии, поскольку использование инсулинотерапии при реанимации пациента в состоянии ДКА является одной из самых распространённых причин для развития клинически значимой гипокалиемии.
Весомая роль отведена также экспресс-оценке кислотности и газов крови. Анализ газов крови при кетоацидозе продемонстрирует снижение рН, снижение концентрации бикарбоната и нормальное (иногда пониженное) значение pCO2 . Обычно у пациентов с ДКА рН < 7.3, HCO3 < 15 мЭкв/л, TCO2 < 12 мЭкв/л .
К сожалению, у автора статьи нет возможности определять концентрацию кетонов в крови. Тем не менее стоит упомянуть, что определение кетонов в крови возможно, в том числе – с использованием экспресс-методик. Кетоз можно обнаружить не только при кетоацидозе, но и при достаточно стабильном (без осложнений) СД. Такой диабетик достаточно хорошо себя чувствует, у него обычно сохраняется аппетит, нет симптомов, демонстрирующих ухудшение общего самочувствия. Лечение пациента-диабетика с кетозом без ацидоза сходно с лечением обычного животного-диабетика. Конечно, в таких случаях будет необходим более тщательный контроль, чем при отсутствии кетоза. Мы не будет рассматривать его в данной статье и остановимся только на диагностике и лечении кетоацидоза и подходу к подобным пациентам .
Концентрация кетонов в моче гораздо выше, чем в плазме . Стандартными лабораторными тест-полосками определяется только наличие ацетоацетата и ацетона . Для проведения данного лабораторного теста моча должна быть обязательно свежесобранная в стерильный контейнер. Совместно с кетонурией при ДКА должна быть диагностирована глюкозурия. Коммерческие мультифункциональные тест-полоски достаточно чувствительны и довольно точны при выявлении кетонурии и глюкозурии. Считается, что степень кетонурии хуже оценивается у мелких домашних животных при использовании коммерческих медицинских мультифункциональных тест-полосок, предназначенных для людей. Это связано с видовыми различиями относительных количеств каждого из продуцируемых кетонов .
Из эфира ацетоуксусной кислоты в присутствии ионов водорода формируется β-оксибутират. Чем ниже кислотность крови, тем больше формируется β-гидроксибутирата . Стандартный, повсеместно используемый тест не определяет β-гидроксибутират, который считается кетоном, выделяемым на ранних стадиях сахарного диабета. Таблетированные ацетатные реагенты для мочи и крови Acetest (Bayer) считаются более чувствительным методом. Если кетонурия не диагностирована, но всё ещё подозревается диагноз ДКА, необходимо провести либо анализ крови на наличие ацетоуксусной кислоты или ацетона при помощи тест-таблеток Acetest, либо на наличие β-гидроксибутирата, используя настольный или ручной иммунохимический/ биохимический анализатор .
С одной стороны, с лабораторной точки зрения диагноз ДКА обычно достаточно легко подтвердить путем выявления стойкой гипергликемии, глюкозурии и кетонурии . С другой, необходимо помнить, что помимо кетоза и кетоацидоза к кетонурии также способны привести и другие патологические и физиологические состояния. Обычно кетоновые тела в моче не присутствуют. Их наличие в моче является результатом повышенного жирового/липидного обмена и сниженного потребления организмом углеводов в качестве источника энергии. К источникам этих нарушений относятся голодание, диета с ограничением содержанием углеводов, лактация, беременность, лихорадка, почечная глюкозурия, болезнь накопления гликогена. Кроме прочего, на уровень кетоновых тел оказывают влияние лекарственные препараты: к ложному повышению кеонов способно привести применение стрептозотоцина, аспирина .
Основные патофизиологические нарушения при ДКА, связанные с гипергликемией, гиперкетонемией, инсулиновой недостаточностью описаны в Табл. №1 .
Результаты гематологического исследования менее специфичны, чем биохимического. Основные находки, выявляемые в ходе этой диагностики – это признаки дегидратации: повышение гематокрита, количества эритроцитов и гемоглобина . Также может быть обнаружена стрессовая лейкограмма, которая является весьма неспецифической находкой . Особенно это изменение характерно при наличии сопутствующих заболеваний воспалительного характера: панкреатите, инфекционных патологиях. При этом будут отмечены лейкоцитоз, сдвиг лейкоцитарной формулы влево . При обнаружении в анализе мочи признаков пиурии и бактериурии такой образец мочи, полученный методом цистоцентеза, следует отправить на культуральное исследование .
Из визуальной диагностики большинству пациентов показаны обзорные рентгенограммы и ультрасонография брюшной полости. Эти методы, в первую очередь, могут помочь провести дифференциальную диагностику, а во-вторых, – обнаружить сопутствующие или осложняющие диабет патологии. Их необходимость определяется данными анамнеза, результатами физического осмотра и природой сопутствующих заболеваний . Считается, что приблизительно у 70% собак с ДКА будут присутствовать сопутствующие заболевания . Безусловно, данные исследования будут актуальны тогда, когда пациент при ДКА стабилизирован достаточно для использования этих методов. Вряд ли целесообразно до оказания первичной помощи пациенту в состоянии средней-тяжелой дегидратации пытаться идентифицировать сопутствующую патологию или причинное состояние, которое могло поспособствовать развитию ДКА. В ходе дополнительной диагностики при наличии подозрений на воспалительные заболевания мочеобразовательной и мочевыделительной системы полезным будет проведение общего анализа и бактериологического исследования мочи .
Таким образом, типичные результаты исследований включают в себя тяжелую гипергликемию, метаболический ацидоз, гиперосмолярность, гипонатриемию, гипокалиемию, гипохлоремию, преренальную азотемию, повышенную активность ферментов печени, гиперхолестеринемию и инфекцию мочевыводящих путей. Постановка диагноза СД требует наличия соответствующих клинических признаков и подтверждения устойчивой гипергликемии натощак, а также глюкозурии. Наличие сопутствующей кетонурии или кетонемии позволяет поставить диагноз диабетический кетоз (ДК), в то время как наличие метаболического ацидоза позволяет поставить диагноз ДКА. В этих отличиях заключаются определяющие критерии дифференциальной диагностики.
Литература
3. Cote Etienne. Clinical Veterinary Advisor: Dogs and Cats, 2nd Edition. — Imprint: Mosby, 2011. — 1784 р.
5. Clinical Veterinary Advisor: Dogs and Cats by Etienne Cote: http://www.clinicalvetadvisor2.com/
6. Kenneth J. Drobatz, Merilee F. Costello. Feline Emergency and Critical Care Medicine, 2010. — 672 p.
7. Mooney C. T., Peterson M. E. Canine and Feline Endocrinology. — BSAVA, 2004. — 248 p.
9. Silverstein D.C., Hopper K. Small Animal Critical Care Medicine, 2nd Edition. Saunders. — 2009. — 1152 p.
10. Sparkes A., Caney S. Feline Medicine., Manson Publishing Ltd. — 2005. — 240 р.
11. Stephen P. DiBartola. Fluid, Electrolyte and Acid-Base Disorders in Small Animal Practice. StLouis, ed. 3, — 2006 p.
12. Textbook of Small Animal Medicine. Editor, John K. Dunn. — W. B. Saunders, 1999. — 1065 p.
13. The feline patient / editor, Gary D. Norsworthy. — 4th ed, 2011. — 1052 р.
15. Нелсон Р., Фелдмен Э. Эндокринология и репродукция собак и кошек. — «Софион», 2008. — 1256 с.
16. Рэмси Й. Работа с нестабильными диабетиками. Материалы «Санкт-Петербургской ветеринарной эндокринологической конференции 2014» (электронное издание материалов).
17. Торранс Э.Д., Муни К. Т. Эндокринология мелких домашних животных. — М.: Аквариум, 2006. — 311 с.
Окончание в следующем номере
И.Ю. Демидова — кафедра эндокринологии ММА им. И.М. Сеченова (зав. — акад. РАМН проф. И.И. Дедов)
Кетоацидоз и кетоацидотическая кома являются одной из основных причин смерти больных сахарным диабетом (СД) в возрасте до 20 лет. Более 16% пациентов, страдающих инсулинзависимым СД (ИЗСД), умирают именно от кетоацидоза или кетоацидотической комы. Риск летального исхода кетоацидоза особенно возрастает в тех случаях, когда фактором, провоцирующим возникновение данного острого осложнения СД, является тяжелое интеркуррентное заболевание.
Выявление ИЗСД на ранних стадиях снизило частоту случаев манифестации данного заболевания в состоянии кетоацидоза до 20%. Обучение больных, страдающих СД, принципам самоконтроля и тактике поведения при неотложных состояниях позволило значительно снизить риск возникновения кетоацидоза – до 0, 5-2% случаев в год.
Изучение нюансов патогенеза кетоацидоза и создание оптимальных схем терапии этого состояния привели к снижению частоты летальных исходов, однако смертность от кетоацидотической комы составляет 7 – 19%, а в неспециализированных лечебных учреждениях этот показатель выше.
Патогенез
Наиболее частыми провоцирующими факторами декомпенсации СД и развития кетоацидоза являются любые интеркуррентные заболевания (острые воспалительные процессы, обострения хронических заболеваний, инфекционные болезни), хирургические вмешательства, травмы, нарушения режима лечения (введение просроченного или неправильно хранившегося инсулина, ошибки в назначении или введении дозы препарата, неисправность в системах введения инсулина, эмоциональные стрессовые ситуации, беременность и прекращение введения инсулина с суицидальной целью.
Ведущую роль в патогенезе кетоацидоза играет абсолютная инсулиновая недостаточность, приводящая к снижению утилизации глюкозы инсулинзависимыми тканями и, соответственно гипергликемии, и тяжелому энергетическому голоду в них. Последнее обстоятельство является причиной резкого повышения в крови уровня всех контринсулиновых гормонов (глюкагона, кортизола, катехоламинов, АКТГ, СТГ), стимуляции процессов гликогенолиза, протеолиза и липолиза, поставляющих субстраты для глюконеогенеза в печени и в меньшей степени в почках. Глюконеогенез в сочетании с прямым нарушением утилизации глюкозы тканями в связи с абсолютным дефицитом инсулина является важнейшей причиной быстро нарастающей гипергликемии, повышения осмолярности плазмы, внутриклеточной дегидратации и осмотического диуреза.
Перечисленные факторы приводят к тяжелой внеклеточной дегидратации, гиповолемическому шоку и к значительным электролитным нарушениям. Дегидратация и гиповолемия являются причиной снижения мозгового, почечного и периферического кровотока, что, в свою очередь, усиливает имеющуюся гипоксию ЦНС и периферических тканей и приводит к развитию олигурии и анурии. Гипоксия периферических тканей способствует активизации в них процессов анаэробного гликолиза и постепенному нарастанию уровня лактата. Относительный дефицит лактатдегидрогеназы при дефиците инсулина и невозможность полной утилизации лактата в цикле Кори являются причиной возникновения лактацидоза при декомпенсации ИЗСД. Дефицит инсулина и резкое повышение концентрации всех контринсулиновых гормонов являются причиной активизации липолиза и мобилизации свободных жирных кислот (СЖК), что способствует активной продукции кетоновых тел. Усиленное образование ацетил-КоА, предшественника ацетоацетата (и ацетона при его декарбоксилировании), и В-гидроксибутирата обеспечивается в данных условиях активным поступлением СЖК в печень вследствие их мобилизации из периферических тканей и преобладанием процессов липолиза над липогенезом в самой клетке печени.
Быстрое нарастание концентрации кетоновых тел при декомпенсации СД обусловлено не только их усиленной продукцией, но и снижением их периферической утилизации и экскреции с мочой в связи с дегидратацией и олигурией, сменившей полиурию. Диссоциация кетоновых тел сопровождается эквимолярной продукцией ионов водорода. В условиях декомпенсации СД продукция кетоновых тел и, следовательно, образование ионов водорода превышают буферную способность тканей и жидкостей организма, что приводит к развитию тяжелого метаболического ацидоза .
Тяжесть состояния при кетоацидозе обусловлена резкой дегидратацией организма, декомпенсированным метаболическим ацидозом, выраженным дефицитом электролитов (калия, натрия, фосфора, магния и др.), гипоксией, гиперосмолярностью (в большинстве случаев) и нередко сопутствующим интеркуррентным заболеванием.
Клиническая картина
Кетоацидоз развивается постепенно в течение нескольких дней. При наличии тяжелой сопутствующей инфекции клиническая картина кетоацидоза разворачивается в более сжатые сроки.
Ранними клиническими симптомами кетоацидоза являются типичные признаки декомпенсации СД, такие как нарастающие сухость слизистых и кожи, жажда, полиурия, впоследствии сменяющаяся олигурией и анурией, слабость, головная боль, сонливость, снижение аппетита, потеря массы тела, появление легкого запаха ацетона в выдыхаемом воздухе. В случае неоказания своевременной помощи метаболические нарушения усугубляются, а описанные выше клинические признаки дополняются неспецифическими симптомами интоксикации и ацидоза, такими как головная боль, головокружение, тошнота и рвота, которая вскоре учащается и приобретает неукротимый характер. Рвотные массы при кетоацидозе нередко имеют кровянисто-коричневатый оттенок и врачи ошибочно принимают это за рвоту «кофейной гущей”. По мере нарастания кетоацидоза запах ацетона в выдыхаемом воздухе усиливается, а дыхание становится частым, шумным и глубоким (респираторная компенсация, дыхание Куссмауля).
Заслуживает особого внимания симптом, наблюдаемый более чем у половины больных – так называемый «абдоминальный синдром” кетоацидоза, проявляющийся клиникой «острого живота”. Нередко сочетание болей в животе, рвоты и наблюдаемого при кетоацидозе лейкоцитоза приводит к диагностическим ошибкам и недопустимым в данном состоянии хирургическим вмешательствам, часто заканчивающимся летально. Риск подобных ошибок особенно велик в случае манифестации СД в состоянии кетоацидоза.
При объективном осмотре отмечаются выраженные признаки обезвоживания (в тяжелых случаях больные теряют до 10 – 12% массы тела). Тургор тканей резко снижается. Глазные яблоки становятся мягкими, а кожные покровы и видимые слизистые – сухими. Язык обложен густым коричневым налетом. Мышечный тонус, сухожильные рефлексы, температура тела и артериальное давление снижены. Определяется частый пульс слабого наполнения и напряжения. Печень, как правило, значительно выступает из-под края реберной дуги и болезненна при пальпации. Дыхание Куссмауля сопровождается резким запахом ацетона в выдыхаемом воздухе.
При осмотре больных в состоянии кетоацидоза необходимо как можно быстрее уточнить причину, спровоцировавшую декомпенсацию СД. При наличии сопутствующего интеркуррентного заболевания следует немедленно приступить к его лечению.
С первых признаков декомпенсации СД у больных отмечаются признаки сначала легкого, а затем все более и более выраженного угнетения ЦНС. Так, сначала пациенты жалуются на головную боль, становятся раздражительными, а затем – вялыми, апатичными, сонливыми. Развивающееся состояние оглушенности характеризуется снижением уровня бодрствования, замедлением сознательных реакций на раздражители и увеличением периодов сна. По мере усугубления метаболических нарушений состояние оглушенности ступором, часто называемым прекоматозным состоянием, клинически проявляющимся глубоким сном или аналогичной ему по поведенческим реакциям ареактивностью. Конечной стадией нарастающего угнетения ЦНС является кома, характеризующаяся полным отсутствием сознания.
При исследовании крови определяются гипергликемия, гиперкетонемия, повышение уровня азота мочевины, креатинина и в ряде случаев – лактата. Уровень натрия в плазме обычно снижен. Несмотря на значительную потерю калия с осмотическим диурезом, рвотными массами и стулом, приводящую к выраженному дефициту данного электролита в организме, его концентрация в плазме может быть нормальной или даже слегка повышенной при анурии. При исследовании мочи определяются глюкозурия, кетонурия и протеинурия. Кислотно-основное состояние (КОС) отражает декомпенсированный метаболический ацидоз, причем в тяжелых случаях рН крови опускается ниже 7,0. На ЭКГ могут быть признаки гипоксии миокарда и нарушения проводимости.
В том случае, если известно о наличии у больного СД, диагностика кетоацидоза и кетоацидотической комы не представляет сложности. Диагноз подтверждается описанной выше клинической картиной, лабораторными показателями (прежде всего гипергликемией, наличием глюкозы и кетоновых тел в моче) и КОС, указывающими на наличие декомпенсированного метаболического ацидоза. В случае манифестации СД сразу в состоянии кетоацидоза или комы прежде всего следует ориентироваться на наличие выраженной дегидратации, признаков ацидоза (дыхание Куссмауля) и значительной потери массы тела за короткий отрезок времени. При этом исследование КОС исключает респираторный алкалоз как причину гипервентиляции и подтверждает наличие у больного метаболического ацидоза. Кроме того, запах ацетона в выдыхаемом воздухе должен навести врача на мысль о наличии у больного именно кетоацидоза. Лактат-ацидоз, уремия, алкогольный кетоацидоз, отравления кислотами, метанолом, этиленгликолем, паральдегидом, салицилатами (остальные причины метаболического ацидоза) не сопровождаются столь выраженной дегидратацией и значительной потерей массы тела, а также проявляются типичной для них клинической картиной. Наличие гипергликемии и кетонурии подтверждает диагноз СД и кетоацидоза.
Лечение
Лечение больных, находящихся в состоянии декомпенсации СД, а тем более в состоянии кетоацидоза или кетоацидотической комы, должно начинаться немедленно. Пациентов госпитализируют в специализированное отделение, а в состоянии комы – в отделение реанимации.
Основными целями терапии кетоацидоза являются борьба с дегидратацией и гиповолемическим шоком, восстановление физиологического КОС, нормализация электролитного баланса, ликвидация интоксикации и лечение сопутствующих заболеваний.
Непосредственно перед началом терапии больному промывают желудок раствором гидрокарбоната натрия. Для контроля функции почек и учета диуреза вводят мочевой катетер. С целью улучшения оксигенации тканей налаживают вдыхание кислорода. Учитывая гипотермию, больного необходмо тепло укрыть, а растворы следует вводить подогретыми.
Для контроля за эффективностью проводимой терапии до начала лечения контролируют гликемию, рН крови, рСО2, уровень К, Na, лактата и кетоновых тел в крови, глюкозурию и кетонурию, АД, ЭКГ, уровень гемоглобина, гематокрит, частоту дыхания (ЧД), пульс. В последующем необходимо ежечасно контролировать гликемию, рН крови, рСО2, АД, ЭКГ, ЧД, пульс. Оценивать прочие показатели можно каждые 2 – 3 ч.
Важное прогностическое значение (особенно в состоянии комы) имеет оценка реакции зрачков на свет. Слабая реакция или полное ее отсутствие свидетельствует о развившихся структурных изменениях в стволе мозга и низкой вероятности благоприятного исхода заболевания.
Регидратация очень важна в лечении диабетического кетоацидоза ввиду большой роли обезвоживания в цепочке метаболических расстройств при данном состоянии. Объем потерянной жидкости восполняется физиологическим (или гипотоническим при гиперосмолярности) и 5 – 10% растворами глюкозы. Прекращение инфузионной терапии возможно лишь при полном восстановлении сознания, отсутствии тошноты, рвоты и возможности приема жидкости больным per os. В течение первого часа внутривенно капельно вводят 1 л 0,9% раствора NaCl. При наличии гиперосмолярности физиологический раствор может быть заменен на гипотонический 0,45% раствор NaCl.
Эффективную осмолярность рассчитывают по следующей формуле:
Осмолярность = 2 + глюкоза крови (мОсм) (ммоль/л), нормальное значение = 297 ± 2 мОсм/л
В течение следующих двух часов от начала терапии ежечасно вводят по 500 мл 0,9% раствора NaCl. В последующие часы скорость введения жидкости обычно не должна превышать 300 мл/ч. После снижения уровня гликемии ниже 14 ммоль/л физиологический раствор заменяют на 5 – 10% раствор глюкозы и вводят со скоростью, указанной выше. Назначение глюкозы на данном этапе диктуется рядом причин, среди которых главная – поддержание необходимой осмолярности крови. Быстрое снижение уровня гликемии и концентрации прочих высокоосмолярных компонентов крови на фоне инфузионной терапии нередко становится причиной нежелательного быстрого снижения осмолярности плазмы.
Инсулинотерапию начинают сразу после постановки диагноза кетоацидоза. При лечении кетоацидоза, как и любого другого ургентного состояния при СД, используют инсулин только короткого действия (Актрапид МС, Актрапид НМ, Хумулин Р, Инсуман Рапид и др. ). До нормализации КОС и снижения уровня гликемии ниже 14,0 ммоль/л инсулин вводят только внутривенно капельно или внутримышечно в прямую мышцу живота. По достижении казанного уровня гликемии и нормализации КОС больного переводят на подкожное введение инсулина короткого действия.
Доза инсулина в первый час лечения составляет 10 ЕД внутривенно струйно или 20 ЕД внутримышечно. В случае сопутствующей тяжелой гнойной инфекции первую дозу инсулина можно увеличить вдвое.
В последующем ежечасно вводят в среднем по 6 ЕД инсулина короткого действия внутримышечно или вместе с физиологическим раствором NaСl внутривенно капельно. Для этого в отдельную емкость с 0,9% раствором NaCl добавляется 10 ЕД инсулина на каждые 100 мл физиологического раствора. Полученную смесь тщательно взбалтывают. С целью адсорбции инсулина на стенках системы через нее пропускают 50 мл смеси струйно. Применение для этой же цели использовавшихся ранее растворов альбумина в настоящее время считается необязательным. Ежечасно внутривенно капельно вводят 60 мл указанной смеси. В том случае, если в течение первых 2 – 3 ч от начала терапии уровень гликемии не снижается, дозу инсулина в последующий час рекомендуется удвоить.
При достижении уровня гликемии 12 – 14 ммоль/л дозу вводимого инсулина уменьшают в 2 раза – до 3 ЕД ежечасно (30 мл смеси инсулина и физиологического раствора). На данном этапе терапии возможен перевод больного на внутримышечные инъекции инсулина, однако следует иметь в виду, что используемые инсулиновые шприцы и различные индивидуальные системы для введения гормона снабжены иглами лишь для подкожного введения инсулина.
Не следует стремиться к снижению уровня гликемии ниже 10 ммоль/л, так как при этом возрастает риск не только гипогликемии, но и прежде всего – гипосмолярности. Тем не менее, если уровень гликемии снижается ниже 10 ммоль/л при сохраняющемся ацидозе, рекомендуется по-прежнему вводить инсулин ежечасно, а дозу снизить до 2 – 3 ЕД/ч. При нормализации КОС (легкая кетонурия при этом может сохраняться) следует перевести больного на подкожное введение инсулина по 6 ЕД каждые 2 ч, а затем – каждые 4 ч в той же дозе.
При отсутствии кетоацидоза на 2 – 3-и сутки лечения больной может быть переведен на 5 – 6 разовое введение инсулина короткого действия, а в дальнейшем – на обычную комбинированную инсулинотерапию.
Восстановление электролитного баланса, прежде всего дефицита калия, является важным компонентом комплексного лечения кетоацидоза. Обычно введение КCl начинают через 2 ч от начала инфузионной терапии. Однако если до начала лечения уже имеются ЭКГ- или лабораторные признаки, подтверждающие гипокалиемию при обязательном отсутствии анурии, введение калия можно начинать сразу, так как введение жидкости и инсулина способствует быстрому снижению уровня калия в крови за счет разведения его концентрации и нормализации транспорта калия в клетку.
Доза раствора KCL, вводимого внутривенно капельно, зависит от концентрации калия в плазме. Так, при уровне калия ниже 3 ммоль/л необходимо вводить 3 г/ч (сухого вещества), при 3 – 4 ммоль/л – 2 г/ч, при 4 – 5 ммоль/л – 1,5 г/ч, при 5 – 6 ммоль/л – 0,5 г/час. По достижении уровня калия в плазме 6 ммоль/л введение раствора KCl следует прекратить.
Как правило, больные не нуждаются в дополнительной коррекции гипофосфатемии. Вопрос о необходимости введения фосфата калия возникает лишь в том случае, если уровень фосфора в плазме снижается ниже 1 мг%.
Восстановление КОС начинается буквально с первых минут лечения кетоацидоза, благодаря назначению жидкости и введению инсулина. Восстановление объема жидкости запускает физиологические буферные системы, в частности, восстанавливается способность почек реабсорбировать бикарбонаты. Назначение инсулина подавляет кетогенез и тем самым снижает концентрацию водородных ионов в крови. Однако в ряде случаев встает вопрос о необходимости назначения гидрокарбоната натрия с целью коррекции КОС. Выше было отмечено, что даже значительный периферический метаболический ацидоз далеко не всегда сопровождается столь же выраженным ацидозом ЦНС, благодаря наличию ряда защитно-приспособительных механизмов. По данным J. Ohman и соавт. J. Posner и F. Plum , у больных с диабетическим кетоацидозом до начала терапии рН спинномозговой жидкости обычно в пределах нормы. Попытки коррекции ацидоза плазмы с помощью внутривенного введения гидрокарбоната натрия могут привести к быстрому развитию ацидоза ЦНС и резкому ухудшению состояния сознания больного. С учетом описанных побочных явлений при введении соды разработаны очень жесткие критерии назначения гидрокарбоната натрия при диабетическом кетоацидозе. Рассматривать вопрос о целесообразности введения соды следует лишь при уровне рН крови ниже 7,0. Необходимо подчеркнуть, что при этом очень важно осуществлять постоянное мониторирование изменений КОС, а при достижении рН значения 7,0 введение гидрокарбоната следует прекратить. Используют 4% раствор гидрокарбоната натрия из расчета 2,5 мл на 1 кг фактической массы тела внутривенно капельно очень медленно. При введении гидрокарбоната натрия дополнительно внутривенно капельно вводят раствор KCl из расчета 1,5 – 2 г KCl сухого вещества .
В целях лечения или профилактики воспалительных заболеваний назначаются антибиотики широкого спектра действия.
Для улучшения реологических свойств крови и предотвращения диссеминированного внутрисосудистого свертывания дважды в первые сутки лечения вводят 5000 ЕД гепарина внутривенно под контролем коагулограммы.
В целях нормализации окислительных процессов добавляют 150 – 200 мл кокарбоксилазы и 5 мл 5% раствора аскорбиновой кислоты.
При низком АД и других симптомах шока проводят терапию, направленную на повышение и поддержание АД и сердечной деятельности.
После выведения больного из состояния кетоацидоза назначают щадящую диету, богатую углеводами, белками, калием. Жиры из рациона питания исключают минимум на неделю.
Осложнения кетоацидоза
Среди осложнений, возникающих на фоне терапии кетоацидоза, наибольшую опасность представляет отек мозга, который в 70% случаев заканчивается летально (R. Couch и соавт., 1991; A. Glasgow, 1991). Наиболее частой причиной возникновения отека мозга является быстрое снижение осмолярности плазмы и уровня гликемии на фоне проводимой инфузионной терапии и введения инсулина. В случае применения гидрокарбоната натрия в целях коррекции ацидоза создаются дополнительные предпосылки для возникновения этого грозного осложнения. Дисбаланс между рН периферической крови и ликвора способствует повышению давления последнего и облегчает транспорт воды из межклеточного пространства в клетки мозга, осмолярность которых повышена. Обычно отек мозга развивается через 4 – 6 ч от начала терапии диабетического кетоацидоза. В том случае, когда сознание у больного сохранено, признаками начинающегося отека мозга являются ухудшение самочувствия, выраженная головная боль и головокружение, тошнота, рвота, расстройства зрения, а также напряжение глазных яблок, нестабильность гемодинамических показателей, нарастающая лихорадка. Как правило, перечисленные клинические симптомы появляются после «светлого” периода улучшения самочувствия на фоне очевидной положительной динамики лабораторных показателей.
Значительно сложнее заподозрить начинающийся отек мозга у больных в состоянии кетоацидотической комы. Верным признаком данного осложнения на начальном этапе является отсутствие положительной динамики в состоянии сознания больного на фоне объективного улучшения показателей углеводного обмена. Описанные выше клинические признаки отека мозга сопровождаются снижением или отсутствием реакции зрачков на свет, офтальмоплегией и отеком зрительного нерва. Ультразвуковая энцефалография и компьютерная томография подтверждают диагноз.
Лечение отека мозга представляет значительно большие трудности, чем диагностика этого состояния. При подтверждении наличия у больного отека мозга назначают осмотические диуретики – внутривенное капельное введение раствора маннитола из расчета 1 – 2 г/кг. Вслед за этим внутривенно струйно вводят 80 – 120 мг лазикса и 10 мл гипертонического раствора натрия хлорида . Вопрос о целесообразности назначения глюкокортикоидов (предпочтение отдается исключительно дексаметазону ввиду его минимальных минералокортикоидных свойств) до конца не решен. Считается, что наибольший эффект от назначения этих гормонов наблюдается при отеке мозга на фоне травмы или опухоли. Однако учитывая способность глюкокортикоидов снижать патологически повышенную проницаемость сосудов и гематоэнцефалического барьера, нормализовывать ионный транспорт через клеточную мембрану и тормозить активность лизосомальных ферментов клеток мозга, вопрос о целесообразности их назначения при отеке мозга при кетоацидозе следует решать индивидуально. К проводимым терапевтическим мероприятиям добавляются гипотермия мозга и активная гипервентиляция легких с целью снижения внутричерепного давления за счет возникающей при этом вазоконстрикции. В ряде случаев следует рассмотреть вопрос о проведении трепанации черепа.
Среди прочих осложнений кетоацидоза и его терапии следует выделить диссеминированное внутрисосудистое свертывание, отек легких, острую сердечно-сосудистую недостаточность, гипокалиемию, метаболический алкалоз, асфиксию вследствие аспирации желудочного содержимого.
Строгий контроль показателей гемодинамики, гемостаза, содержание электролитов, изменений осмолярности и неврологических симптомов позволяет заподозрить перечисленные выше осложнения на ранних стадиях и немедленно принять действенные меры, направленные на их ликвидацию.
Литература: