Вирус (лат. virus — яд) — субклеточный инфекционный агент, который может воспроизводиться только внутри живых клеток организма. По природе вирусы являются автономными генетическими элементами, имеющими внеклеточную стадию в цикле развития. Вирусы представляют собой микроскопические частицы, состоящие из молекул нуклеиновых кислот — ДНК или РНК (некоторые, например мимивирусы, имеют оба типа молекул), заключённые в белковую оболочку, способные инфицировать живые организмы. Белковую оболочку, в которую упакован геном, называют «капсид». Наличие капсида отличает вирусы от вирусоподобных инфекционных нуклеиновых кислот — вироидов. Вирусы, за редким исключением, содержат только один тип геномной нуклеиновой кислоты. Классифицируют ДНК-содержащие вирусы и РНК-содержащие вирусы, на чём основана классификация вирусов по Балтимору. Ранее к вирусам также ошибочно относили прионы, однако впоследствии оказалось, что эти возбудители представляют собой особые инфекционные белки и не содержат нуклеиновых кислот.
Вирусы являются облигатными паразитами, так как не способны размножаться вне клетки. Вне клетки вирусные частицы не проявляют признаки живого и ведут себя как частицы органических полимеров. От живых организмов-внутриклеточных паразитов отличаются полным отсутствием основного и энергетического обмена, и отсутствием сложнейшего элемента живых систем — аппарата трансляции (синтеза белка), степень сложности которого превышает таковую самих вирусов.
В настоящее время известны вирусы, размножающиеся в клетках растений, животных, грибов и бактерий (последних обычно называют бактериофагами или фагами). Несмотря на некоторые общие закономерности строения и стратегии развития (связанные с функциональной общностью), вирусы не имеют общего происхождения. Это подтверждается тем, что геномы вирусов, инфицирующих далёкие между собой группы организмов, структурно родственны, но притом имеют общую структуру генов и регуляторных элементов, кодируют структурно близкие белки, имеют общие механизмы регуляции экспрессии генов. Обнаружены также вирусы, поражающие другие вирусы (вирусы-сателлиты).
Содержание
История исследований
Впервые существование вируса (как нового типа возбудителя болезней) доказал в 1892 году русский учёный Д. И. Ивановский. После многолетних исследований заболеваний табачных растений, в работе, датированной 1892 годом, Д. И. Ивановский приходит к выводу, что табачная мозаика вызывается «бактериями, проходящими через фильтр Шамберлана, которые, однако, не способны расти на искусственных субстратах».
Пять лет спустя, при изучении заболеваний крупного рогатого скота, а именно — ящура, был выделен аналогичный фильтрующийся микроорганизм. А в 1898 году, при воспроизведении опытов Д. Ивановского голландским ботаником М. Бейеринком, он назвал такие микроорганизмы «фильтрующимися вирусами». В сокращённом виде, это название и стало обозначать данную группу микроорганизмов.
В 1901 году было обнаружено первое вирусное заболевание человека — жёлтая лихорадка. Это открытие было сделано американским военным хирургом У. Ридом и его коллегами.
В 1911 году Фрэнсис Раус доказал вирусную природу рака — саркомы Рауса (лишь в 1966 году, через 55 лет, ему была вручена за это открытие Нобелевская премия по физиологии и медицине).
В последующие годы изучение вирусов сыграло важнейшую роль в развитии эпидемиологии, иммунологии, молекулярной генетики и других разделов биологии. Так, эксперимент Херши-Чейз стал решающим доказательством роли ДНК в передаче наследственных свойств. В разные годы еще как минимум шесть Нобелевских премий по физиологии и медицине и три Нобелевских премии по химии были вручены за исследования, непосредственно связанные с изучением вирусов.
В 2002 году в Нью-Йоркском университете был создан первый синтетический вирус (вирус полиомиелита).
Строение
Просто организованные вирусы состоят из нуклеиновой кислоты и нескольких белков, образующих вокруг неё оболочку — капсид. Примером таких вирусов является вирус табачной мозаики. Его капсид содержит один вид белка с небольшой молекулярной массой. Сложно организованные вирусы имеют дополнительную оболочку — белковую или липопротеиновую; иногда в наружных оболочках сложных вирусов помимо белков содержатся углеводы. Примером сложно организованных вирусов служат возбудители гриппа и герпеса. Их наружная оболочка — это фрагмент ядерной или цитоплазматической мембраны клетки-хозяина, из которой вирус выходит во внеклеточную среду.
Структура
Примеры структур икосаэдрических вирионов.
А. Вирус, не имеющий липидной оболочки (например, пикорнавирус).
B. Оболочечный вирус (например, герпесвирус).
Вирусные частицы (вирио́ны) представляют собой белковую капсулу — капсид, содержащую геном вируса, представленный одной или несколькими молекулами ДНК или РНК. Капсид построен из капсомеров — белковых комплексов, состоящих, в свою очередь, из протомеров. Нуклеиновая кислота в комплексе с белками обозначается термином нуклеокапсид. Некоторые вирусы имеют также внешнюю липидную оболочку. Размеры различных вирусов колеблются от 20 (парвовирусы) до 500 (мимивирусы) и более нанометров. Вирионы часто имеют правильную геометрическую форму (икосаэдр, цилиндр). Такая структура капсида предусматривает идентичность связей между составляющими её белками, и, следовательно, может быть построена из стандартных белков одного или нескольких видов, что позволяет вирусу экономить место в геноме.
Вирус табачной мозаики
(1) РНК-геном вируса, (2) капсомер, состоящий всего из одного протомера, (3) зрелый участок капсида.
‘ (1) РНК-геном вируса, (2) капсомер, состоящий всего из одного протомера, (3) зрелый участок капсида.
Механизм инфицирования
Условно процесс вирусного инфицирования в масштабах одной клетки можно разбить на несколько взаимоперекрывающихся этапов:
1.Присоединение к клеточной мембране — так называемая адсорбция. Обычно для того, чтобы вирион адсорбировался на поверхности клетки, она должна иметь в составе своей плазматической мембраны белок (часто гликопротеин) — рецептор, специфичный для данного вируса. Наличие рецептора нередко определяет круг хозяев данного вируса, а также его тканеспецифичность.
2.Проникновение в клетку. На следующем этапе вирусу необходимо доставить внутрь клетки свою генетическую информацию. Некоторые вирусы переносят также собственные белки, необходимые для её реализации (особенно это характерно для вирусов, содержащих негативные РНК). Различные вирусы для проникновения в клетку используют разные стратегии: например
пикорнавирусы впрыскивают свою РНК через плазматическую мембрану
вирионы ортомиксовирусов захватываются клеткой в ходе эндоцитоза, попадают в кислую среду лизосом, где происходит их окончательное созревание (депротеинизация вирусной частицы), после чего РНК в комплексе с вирусными белками преодолевает лизосомальную мембрану и попадает в цитоплазму.
Вирусы также различаются по локализации их репликации, часть вирусов (например, те же пикорнавирусы) размножается в цитоплазме клетки, а часть (например, ортомиксовирусы) в её ядре.
3.Перепрограммирование клетки. При заражении вирусом в клетке активируются специальные механизмы противовирусной защиты. Заражённые клетки начинают синтезировать сигнальные молекулы — интерфероны, переводящие окружающие здоровые клетки в противовирусное состояние и активирующие системы иммунитета. Повреждения, вызываемые размножением вируса в клетке, могут быть обнаружены системами внутреннего клеточного контроля, и такая клетка должна будет «покончить жизнь самоубийством» в ходе процесса, называемого апоптозом или программируемой клеточной смерти. От способности вируса преодолевать системы противовирусной защиты напрямую зависит его выживание. Неудивительно, что многие вирусы (например, пикорнавирусы, флавивирусы) в ходе эволюции приобрели способность подавлять синтез интерферонов, апоптозную программу и так далее. Кроме подавления противовирусной защиты, вирусы стремятся создать в клетке максимально благоприятные условия для развития своего потомства. Хрестоматийным примером перепрограммирования систем клетки-хозяина является трансляция РНК энтеровирусов (семейство пикорнавирусы). Вирусная протеаза расщепляет клеточный белок eIF4G, необходимый для инициации трансляции подавляющего большинства клеточных мРНК (транслирующихся по так называемому кэп-зависимому механизму). При этом инициация трансляции РНК самого вируса происходит другим способом (IRES-зависимый механизм), для которого вполне достаточно отрезанного фрагмента eIF4G. Таким образом, вирусные РНК приобретают эксклюзивные «права» и не конкурируют за рибосомы с клеточными.
4.Персистенция. Некоторые вирусы могут переходить в латентное состояние (так называемая персистенция для вирусов эукариот или лизогения для бактериофагов — вирусов бактерий), слабо вмешиваясь в процессы, происходящие в клетке, и активироваться лишь при определённых условиях. Так построена, например, стратегия размножения некоторых бактериофагов — до тех пор, пока заражённая клетка находится в благоприятной среде, фаг не убивает её, наследуется дочерними клетками и нередко интегрируется в клеточный геном. Однако при попадании заражённой лизогенным фагом бактерии в неблагоприятную среду, возбудитель захватывает контроль над клеточными процессами так, что клетка начинает производить материалы, из которых строятся новые фаги (так называемая литическая стадия). Клетка превращается в фабрику, способную производить многие тысячи фагов. Зрелые частицы, выходя из клетки, разрывают клеточную мембрану, тем самым убивая клетку. С персистенцией вирусов (например, паповавирусов) связаны некоторые онкологические заболевания.
5.Создание новых вирусных компонентов. Размножение вирусов в самом общем случае предусматривает три процесса — 1) транскрипция вирусного генома — то есть синтез вирусной мРНК, 2) её трансляция, то есть синтез вирусных белков и 3) репликация вирусного генома (в некоторых случаях, когда генетическая информация вируса закодирована в виде РНК геномная РНК одновременно играет роль мРНК, и, следовательно, процесс транскрипции в паразитируемой клетке не происходит за ненадобностью). У многих вирусов существуют системы контроля, обеспечивающие оптимальное расходование биоматериалов клетки-хозяина. Например, когда вирусной мРНК накоплено достаточно, транскрипция вирусного генома подавляется, а репликация напротив — активируется.
6.Созревание вирионов и выход из клетки. В конце концов, новосинтезированные геномные РНК или ДНК одеваются соответствующими белками и выходят из клетки. Следует сказать, что активно размножающийся вирус не всегда убивает клетку-хозяина. В некоторых случаях (например, ортомиксовирусы) дочерние вирусы отпочковываются от плазматической мембраны, не вызывая её разрыва. Таким образом, клетка может продолжать жить и продуцировать вирус.
Классификация
В таксономии живой природы вирусы выделяются в отдельный таксон Vira, образующий в классификации Systema Naturae 2000 вместе с доменами Bacteria, Archaea и Eukaryota корневой таксон Biota. В течение XX века в систематике выдвигались предложения о создании выделенного таксона для неклеточных форм жизни (Aphanobionta Novak, 1930; надцарство Acytota Jeffrey, 1971; Acellularia), однако такие предложения не были кодифицированы.
Систематику и таксономию вирусов кодифицирует и поддерживает Международный Комитет по Таксономии Вирусов (International Committee on Taxonomy of Viruses, ICTV), поддерживающий также и таксономическую базу The Universal Virus Database ICTVdB.
Классификация ICTV
Международным Комитетом по Таксономии Вирусов в 1966 году была принята система классификации вирусов основанная на различии типа (РНК и ДНК), количества молекул нуклеотических кислот (одно- и двух-цепочечные) и на наличии или отсутствии оболочки ядра. Система классификации представляет собой серию иерархичных таксонов:
Отряд (-virales)
Семейство (-viridae)
Подсемейство (-virinae)
Род (-virus)
Вид (-virus)
Классификация Балтимора
Нобелевский лауреат, биолог Дэвид Балтимор, предложил свою схему классификации вирусов, основываясь на различиях в механизме продукции мРНК. Эта система включает в себя семь основных групп:
(II) Вирусы, содержащие двуцепочечную РНК (например, ротавирусы).
(III) Вирусы, содержащие одноцепочечную молекулу ДНК (например, парвовирусы).
(IV) Вирусы, содержащие одноцепочечную молекулу РНК положительной полярности (например, пикорнавирусы, флавивирусы).
(V) Вирусы, содержащие одноцепочечную молекулу РНК негативной или двойной полярности (например, ортомиксовирусы, филовирусы).
(VI) Вирусы, содержащие одноцепочечную молекулу РНК и имеющие в своем жизненном цикле стадию синтеза ДНК на матрице РНК, ретровирусы (например, ВИЧ).
(VII) Вирусы, содержащие двуцепочечную ДНК и имеющие в своём жизненном цикле стадию синтеза ДНК на матрице РНК, ретроидные вирусы (например, вирус гепатита B).
В настоящее время, для классификации вирусов используются обе системы одновременно, как дополняющие друг друга
Дальнейшее деление производится на основе таких признаков как структура генома (наличие сегментов, кольцевая или линейная молекула), генетическое сходство с другими вирусами, наличие липидной оболочки, таксономическая принадлежность организма-хозяина и так далее.
Хлоргексидин входит в список антисептических, дезинфицирующих средств. Раствор хлоргексидина с глюкозой применяют для дезинфекции поверхности кожи перед, во время, и после операционного вмешательства.
Состав и форма выпуска
Основное действующее вещество препарата – хлоргексидин.
Он идет в виде раствора с глюкозой.
У разных производителей вспомогательные вещества отличаются:
- ООО «Славия 2000» – Кировоград – вода очищенная.
- ООО «Производственное объединение «Тетерев»»– Киевская обл. ПАО» Биолек «– Винницкая обл, ООО «Торговый дом «МВК» – Одесса – вода очищенная.
- ООО «Фарма Черкасс» – Черкассы – вода очищенная.
- ПАО «Химфармзавод»Красная звезда»»– Харьков – хлоргексидин диглюконат 20% (0,05) и вода очищенная
- ООО «Фармацевтическая компания «Здоровье»»– Харьков – хлоргексидин диглюконат 20% (0,05) и вода очищенная.
- ЗАО Фармацевтическая фабрика «Виола» – Запорожье – хлоргексидин диглюконат 20% (0,25мл) и вода очищенная
- ЧП «Килафф» – Сумы – хлоргексидина биглюконата (20%) 0,25 мл, вода очищенная.
Хлоргексидин – прозрачная жидкость без запаха. Продается в бутылочках по 50, 100 и 200 мл. В комплекте могут идти насадки для удобства использования.
Фармакологические свойства
Хлоргексидин (1,6-ди- (пара-хлорфенил-гуанида) –гексан) – катионный бигуанид, который содержит аминогруппы клеточных белков и относится к антисептикам. Хлоргексидин эффективно действует на все грамположительные и грамотрицательные бактерии, кроме группы кислотостойких грамотрицательных. Также зафиксировано эффективное действие против грибков, вирусов, а также протею и псевдомонад. Было замечено бактерицидное действие вещества во всех жидкостях организма – даже в гное, но замедленное.
Действующее вещество проникает через мембраны клеток, оседает на цитоплазме и препятствует поступлению кислорода, что приводит к недостатку АФТ и разрушению клеток. Кроме того, он разрушает ДНК-цепи в клетках микроорганизмов, а затем препятствует синтезу ДНК, чем останавливает развитие болезни. Его эффект длится 6 часов после применения.
Хлоргексидин действует на такие вирусы, бактерии и микроорганизмы:
- Грамположительные и грамотрицательные – reponema pallidum, Chlamidia spp., Ureaplasma spp., Neisseria gonorrhoeae, Gardnerella vaginalis, Bacteroides fragilis;
- Простейшие – Trichomonas vaginalis;
- Вирусы – Herpes virus;
Хлоргексидин не проникает через интактную кожу, и при попадании в пищевод, почти полностью не всасывается в желудочно-корзинный тракте. На 90% выводится с калом, и на 1% почками. В случае неосторожного приема 300 мг препарата максимальная концентрация через 30 мин составляет 0,206 мкг/л
Показания
Хлоргексидин используют в качестве антисептика при операциях, для обработки ран, ссадин, ожогов, для профилактики венерических болезней и для лечения воспалений, и инфекций в акушерстве, и гинекологии (при осмотре у врачей, во время родов, операций, и тд).
Его могут использовать для лечения некоторых начальных форм заболеваний ротовой полости, десен и горла (пародонтит, гингивит, альвеолит, стоматит, афты). Хлоргексидин используется для обработки хирургических инструментов, инструментов, имеющих контакт с жидкостями организма, медицинских аппаратов и мебели.
Противопоказания
Запрещен прием хлоргексидина внутрь. Противопоказан раствор хлоргексидина людям, у которых аллергия на его компоненты, острое воспаление, тяжелые кожные дерматиты.
Не применяется с другими антисептиками и дезинфицирующими средствами. Не следует промывать раны и ожоговые поверхности с большой площадью поражения. Не используется вместе с мылом. Применение с йодом способно вызвать аллергические реакции и дерматиты.
Следует предотвращать попадание хлоргексидина на барабанную перепонку и в глаза. В случае операции на открытом мозге, нельзя допустить попадания хлоргексидина на его поверхность.
Хлоргексидин нельзя стерилизовать ионизирующем облучением, а только в автоклаве при 116 градусах Цельсия в течение 30 минут.
Применение при беременности и кормлении грудью
Негативно влияет на организм применение во время беременности и лактации. Применение хлоргексидина только в критических случаях, а в случае применения при лактации необходимо ее приостанавливать, пока полностью выведется хлоргексидин.
Способность влиять на скорость реакции
За Хлоргексидином не было замечено влияния на реакции и способность управлять авто и механизмами, а также на психологическое состояние пациентов.
Способ применения и дозы
Хлоргексидин не применялся детям до 12 лет.
При обработке поверхности кожи или раны, раствор хлоргексидина наносится на бинт, которым промокают необходимое место. При необходимости смоченный хлоргексидином бинт закрепляют повязкой или пластырем.
Препарат до сих пор иногда применяется для промывания мочевого пузыря врачом.
Иногда некоторые врачи рекомендуют его для профилактики определенных венерических заболеваний, но эффективность хлоргексидина для них сомнительна.
Для этого надо помочиться, после чего вымыть руки, свои половые органы, под давлением омыть лобок, бедра, половые органы. Затем необходимо ввести носик бутылочки в отверстие половых органов и с силой надавить. Для мужчин ориентировочно необходимо влить 1,5–3 мл раствора, а для женщин 1–1,5 мл. Все, что останется используют для омовения половых органов.
Напоминаем, что подобное использование препарата назначается врачом – самостоятельно можно нанести большой вред, назначив препарат без ведома врачей.
Для лечения уретритов и уретропростатитов необходимо впрыскивать 2–3 мл хлоргексидина 1–2 р/день в течение 10 дней.
Для орошения пораженных поверхностей кожи используют 5–10 мл хлоргексидина методом впрыска или смазывания тампоном в течение 1–3 минут 2–3 р/сутки.
Взаимодействие с препаратами
Раствор хлоргексидина не следует применять со следующими веществами из-за образования труднорастворимых осадков:
- Сульфатами;
- Карбонатами;
- Цитрат;
- Боратами;
- Хлоридами;
- Фосфатами;
Хлоргексидин несовместим с йодом из-за возникновения дерматитов. Также он несовместим, с мылом и другими анионными соединениями – натрия лаурилсульфатом, карбоксиметилцеллюлозой, коллоидами, гуммиарабиком и сапонинами.
Этанол усиливает эффект хлоргексидина, а сам препарат совместим в использовании с препаратами катионной группы – бензалкония хлорида, цетримония бромида.
Передозировка
В случае ошибочного приема препарата (300 мл) внутрь может наступить смертельный случай из-за осложнений в печени.
Побочные действия
От хлоргексидина могут начаться разные формы аллергических реакций. В случае применения в гинекологии или урологии, возможны неприятные ощущения и зуд.
Препарат запрещено глотать. Если по какой-то причине он попал в желудок, возможны рвота, спазмы, интоксикация.
В случае проявления негативных эффектов, необходимо срочно обращаться к врачу.
Срок и условия хранения
Хлоргексидин необходимо хранить темном сухом месте в течение 3 лет при температуре до 25 градусов Цельсия.
Цена
Лечение геморроя и анальных трещин.
Что такое геморрой? Представьте себе, что у Вас в заднем месте 32 зуба и они все болят!
Такое описание геморроя я как-то услышал от больного с многолетним стажем. Но к врачу
он упорно не хотел идти, продолжая терпеть и стесняться…
Некоторым мешает обратиться к врачу-проктологу стеснительность, других отпугивает
высокая стоимость лечения или страх перед операцией. Кто-то на себе убедился в безразличии
и безграмотности многих наших «врачей» и не хочет больше обращаться к ним за «помощью»…
А болезнь, тем временем прогрессирует, и мы доходим до той стадии, когда без хирургического
вмешательства уже не обойтись. СТОП! Вы хотите на операционный стол? Нет? Тогда
читаем дальше.
В аптеках продается огромное количество различных мазей и свечей. Действительно, какое-то
время они помогают, особенно на ранней стадии развития болезни. Но потом организм начинает
привыкать, эффективность медикаментозных средств резко снижается. Болезнь прогрессирует.
Происходит это потому, что в складках воспаленного ануса скапливаются остатки фекалий и
сгустки крови. В них быстро начинают развиваться процессы гниения. Происходит инфицирование
ран, воспалительный процесс увеличивается. Обычное наружное подмывание из душа не помогает:
вода не проникает в складки внутри ануса.
Выход очень простой: для дезинфекции ануса используем клизму. Но обычная клизма не только
не поможет, но причинит вред. Действительно, частые промывания прямой кишки нарушают
её микрофлору с неизбежно возникающими неприятными последствиями. На наконечник клизмы
необходимо надеть другой наконечник – с боковыми отверстиями. Проще всего взять наконечник
от тюбика с мазью, которой Вы пользуетесь.

Теперь вода будет размывать то место, где скапливаются неприятности и не попадет выше.
Но пользоваться такой составной клизмой не очень удобно: второй наконечник плохо держится
на первом, спадает в самый неподходящий момент. Лучше будет сделать переходник из корпуса
обычной пластмассовой ручки, на который по резьбе накручивается колпачок. К сожалению,
диаметр и шаг резьбы у ручки и колпачка не совпадают, придется обратиться к слесарю.

Следующий неприятный момент: как правило, приходится прикладывать определенные усилия
к выдавливанию воды из клизмы. Представьте себе, одной рукой Вы давите на клизму, другой
пытаетесь направлять (поворачивать) наконечник в собственном анусе. Согласитесь, делать
это одновременно не очень удобно. Гораздо проще будет добавить небольшой насосик для
создания необходимого напора воды. Для этой цели хорошо подходит насос омывателя лобового
стекла автомобиля.

Подключаем насос к блоку питания с регулировкой напряжения от 3,5 до 15 Вольт.
Регулировка напряжения необходима для создания оптимального давления воды.
Сама клизма уже не нужна, используем любую емкость объёмом 2-5 литров. Безусловно,
не стоит пользоваться водой без её предварительного фильтрования и кипячения.
Некоторые проктологи советуют добавить в воду несколько кристаллов марганцовки.
Но марганцовка не лучший вариант – сильно сушит кожу. Более эффективным и менее
вредным средством (по совету тех же проктологов) является хлоргексидин 0,05%.
Однако его стоимость может оказаться значительной, особенно, если покупать хлоргексидин
в аптеке. Обычная расфасовка 75-100 мл. А для каждой клизмы необходимо 1,5-5 литров.
Не менее эффективным оказалось применение активированной воды, получаемой в
ЭЛЕКТРОЛИЗЕРЕ – АКТИВАТОР ДЛЯ ПРИГОТОВЛЕНИЯ ЖИВОЙ И МЕРТВОЙ ВОДЫ
О пользе такой воды можно прочитать книгу на том же сайте: http://www.kwatro.ru/book_PTVA.rar
При использовании активированной воды для клизмы процедуру необходимо проводить
в два этапа. Сначала используем для обеззараживания мертвую (кислую) воду, затем
обязательно промываем живой (щелочной) водой. Подробные рекомендации в книге.
Как показывает опыт, при использовании такой клизмы воспалительный процесс успешно
снимается за 3-5 дней. Практически полное выздоровление наступает в течение 2 недель
(кроме лечения свищей – их необходимо оперировать).
Смазывать наконечник клизмы лучше не вазелином, а той проктологической мазью, которой
Вы пользуетесь. После клизмы не забудьте использовать мазь по прямому назначению.
В этом случае мазь будет работать наиболее эффективно.
Из опыта знакомых и моего:
Вероятно, наиболее эффективная мазь на сегодняшний день – пастеризан форте.
Но максимальное время, в течении которого рекомендуется её применять – 2 недели.
Обратите внимание: мазь действует эффективнее, чем свечи, т.к. ложится именно на
нужное место, а свечка проталкивается выше.
Впрочем, если по истечении 2 недель Вы не стали себя чувствовать значительно лучше,
значит, пора все-таки идти к проктологу, не откладывая это на завтра.
Крепкого Вам здоровья!
Факт увеличения числа заболевших женщин с тенденцией к омоложению болезни является весьма тревожным, т. к. этот контингент пациенток представляет собой не только репродуктивно значимую часть населения, но и группу, активную в социальном отношении .
Так, за последние годы зарегистрировано увеличение почти вдвое числа заболевших женщин в возрасте от 20 до 40 лет (41,21%). Особенно заметный рост наблюдается в группе моложе 29 лет, где прирост этого показателя за прошедшее десятилетие составил 150% .
Важная роль в канцерогенезе РШМ отводится вирусу папилломы человека высокого канцерогенного риска (ВПЧ ВКР) . Папилломавирусная инфекция (ПВИ) является одной из наиболее распространенных инфекций, передающихся половым путем, инфицированность ею сексуально активного населения планеты составляет 20–60% . Принято считать, что ВПЧ-инфекция является ранним показателем предракового состояния , а у 15–20% инфицированных ПВИ вызывает ВПЧ-индуцированный рак генитальной сферы .
Развитию инвазивного РШМ предшествуют внутриэпителиальные клеточные атипические изменения, обозначаемые как цервикальные интраэпителиальные неоплазии (ЦИН) разной степени выраженности, и карцинома in situ — состояния, при которых в части клеток обнаруживаются признаки клеточного и ядерного атипизма и нарушения анизотропности эпителиального пласта без разрушения базальной мембраны и проникновения атипических клеток в подлежащие ткани. Считается, что ЦИН представляют собой предынвазивный аналог инвазивного плоскоклеточного рака .
Известно, что больные с дисплазией многослойного плоского эпителия (МПЭ) относятся к группе высокого риска развития инвазивной карциномы, тем не менее, процесс злокачественной трансформации происходит в течение достаточно длительного времени, что дает возможность проведения соответствующих лечебных мероприятий, препятствующих развитию рака .
В настоящее время не существует ни одного метода прогнозирования течения ЦИН у конкретной больной, определяющего возможность стойкой персистенции или прогрессии в более высокую степень либо в инвазивный РШМ, с указанием точного времени длительности этого процесса .
Очевидно, что недостаточность скринингового контроля, ограниченные возможности традиционных методов обследования значительно затрудняют своевременное выявление преинвазивных патологических цервикальных состояний. Особую трудность представляет диагностика латентной и субклинической форм ВПЧ-инфекции, которые часто сосуществуют с клинически манифестированными состояниями цервикального эпителия, предрасполагая к рецидивам после удаления видимого очага опухоли, связанным с персистенцией вируса в сопредельных тканях.
Известно, что даже конизация шейки матки не всегда дает полный лечебный эффект, т. к. в оставшемся МПЭ могут сохраняться нерезицированные очаги неоплазии, составляя от 5 до 28% .
Вышеизложенное диктует необходимость поиска новых методов диагностики и терапии цервикальной патологии, нацеленных на снижение хронических (персистентных) папилломатозных инфекций, которые служат предшественниками инвазивных раковых опухолей .
Решение этих задач стало возможным благодаря применению в клинической онкогинекологии новейших методов визуализации биотканей и усовершенствованию лечения цервикальной патологии, основанных на достижениях химии, биологии и квантовой физики.
В собственном исследовании особенностью диагностического процесса явилось включение в него оптической когерентной томографии (ОКТ) в новой, скоростной модификации. Комплекс лечебных мероприятий дополнился использованием комбинированного препарата Депантол в качестве реабилитационного мероприятия после деструкции шейки матки и фотодинамической терапии (ФДТ) в случае наличия по данным морфологии в крае резекции признаков ВПЧ-инфекции.
Цель исследования: повысить эффективность органосохраняющего лечения ЦИН у женщин репродуктивного возраста путем включения в диагностический процесс ОКТ в скоростной модификации и использования в комплексе лечебных мероприятий комбинированного препарата Депантол и ФДТ.
Материалы и методы
В исследование вошли 42 пациентки с H-SIL (ЦИН II–III), с-r in situ шейки матки в возрасте от 19 до 38 лет. Всем больным было проведено комплексное обследование: оценка биоты нижнего отдела гениталий (качественный ПЦР-анализ на абсолютные патогены, «Фемофлор», мазок на флору влагалища), ВПЧ-тестирование, типирование, определение вирусной нагрузки — ПЦР в реальном времени. Дальнейшие диагностические мероприятия, проводившиеся после восстановления биоценоза влагалища с назначением по показаниям этиотропной терапии, включали в себя жидкостное цитологическое исследование, иммуноцитохимическое обследование на наличие белка p16ink4a и/или биопсию шейки матки, ОКТ-кольпоскопию (кольпоскопия с проведением традиционных тестов + ОКТ в скоростной модификации).
ОКТ в скоростной модификации — метод прижизненной визуализации биотканей в результате зондирования их низкоинтенсивным светом ближнего инфракрасного диапазона, позволяющий в отличие от классической ОКТ охарактеризовать не только структурные, но и функциональные особенности ткани.
Основной диагностической задачей являлось определение истинных размеров патологического очага, который характеризовался совокупностью анормальных кольпоскопических и ОКТ-признаков.
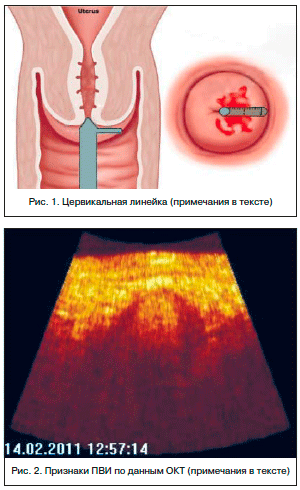
После расширенного кольпоскопического исследования с применением стандартной пробы с уксусной кислотой проводилось скоростное ОКТ-сканирование зон максимальных кольпоскопических изменений. Для этого зонд от оптического томографа прижимался к зонам интереса на 12 с целью обнаружения внутри них участков, имеющих большие степени негативных оптических характеристик. Далее осуществлялось пошаговое скоростное ОКТ-сканирование этих участков по лучу, следующему от цервикального канала до сводов влагалища. Отдаленность поражений от цервикального канала фиксировалась в миллиметрах с помощью специальной цервикальной линейки, разработанной на базе кафедры акушерства и гинекологии НижГМА (рис. 1). Граница перехода сомнительных и злокачественных ОКТ-изображений в доброкачественные, выявленная с помощью линейки, обозначалась как планируемый эктоцервикальный край резекции. В кольпоскопическом протоколе помимо общепринятых данных отмечались луч ОКТ-зондирования соответственно часам мнимого циферблата, планируемый эктоцервикальный край резекции по этому лучу в миллиметрах и наличие признаков ПВИ за пределами планируемого края резекции. К признакам ПВИ по данным ОКТ относятся: снижение скорости угасания оптического сигнала, субэпителиальный отек и полнокровие, наличие многокамерных, сообщающихся «окон» — полостей в базальных слоях многослойного плоского неороговевающего цервикального эпителия. Данные ОКТ-проявления на фоне доброкачественного изображения расценивались как резервуар ПВИ (рис. 2).
Первым этапом лечения всех пациенток явилось выполнение им электроконизации шейки матки с последующим выскабливанием цервикального канала и гистологической оценкой эндоцервикального края резекции. Эктоцервикальный край тщательно исследовался путем микроскопического обследования серийных или ступенчатых срезов с изучением маркированного нитью луча, наиболее подозрительного по данным ОКТ-кольпоскопии на наличие ВПЧ-ассоциированных эпителиальных поражений.
В послеоперационном периоде 22 пациенткам с целью профилактики воспалительных осложнений и стимуляции регенеративных свойств с 3-го дня деструкции во влагалище вводился комбинированный препарат Депантол по 1 вагинальному суппозиторию 2 р./сут в течение 10 дней. Они составили опытную группу. В контрольной группе (20 пациенток) реабилитационных мероприятий после электроконизации шейки матки не проводилось.
Депантол — комбинированный препарат, оказывающий регенерирующее, противомикробное, метаболическое действие. Форма выпуска: вагинальные суппозитории. В состав 1 вагинального суппозитория входит декспантенол — 100 мг и хлоргексидина биглюконат — 16 мг.
Хлоргексидина биглюконат активен в отношении грамположительных и грамотрицательных бактерий: Treponema pallidum, Chlamydia spp., Ureaplasma spp., Neisseria gonorrhoeae, Gardnerella vaginalis, Bacteroides fragilis, Escherichia coli, Staphylococcus spp., Streptococcus spp.; дрожжей, дерматофитов, простейших (Trichomonas vaginalis). К хлоргексидину слабочувствительны некоторые штаммы Pseudomonas spp., Proteus spp., а также устойчивы кислотоустойчивые формы бактерий, споры бактерий.
Декспантенол стимулирует регенерацию слизистых оболочек, нормализует клеточный метаболизм, ускоряет митоз и увеличивает прочность коллагеновых волокон.
Депантол не нарушает функциональную активность лактобацилл. Сохраняет активность (хотя и несколько сниженную) в присутствии крови, гноя.
Клинический мониторинг за репарацией поврежденной ткани осуществляли на 7-10-й день после деструкции и через 30 дней после вмешательства с помощью ОКТ-кольпоскопии. Микробиологическое исследование проводили через 30 дней после операции.
После получения результатов гистологического исследования операционного материала пациенткам с наличием в крае резекции признаков ВПЧ-инфекции проводилась ФДТ.
ФДТ — двухкомпонентный метод лечения опухолевых заболеваний, основанный на эффектах взаимодействия фотосенсибилизатора (ФС) и света строго определенной длины волны. В результате реализации фотодинамической реакции происходят геморрагический некроз опухолевой ткани и ее замещение соединительнотканными структурами. Фотохимическая реакция включает в себя прямую гибель клеток за счет синглетного кислорода, повреждение сосудистого русла опухолевой ткани, иммунный ответ .
Лазерное воздействие на шейку матки осуществлялось в первую фазу менструального цикла (при исключенной беременности) через 1,5–2 ч после введения фотосенсибилизатора хлоринового ряда в дозе 1 мг/кг. Препарат вводился в/в 200 мл физиологического раствора в течение 30 мин.
Использовалась полипозиционная методика лазерного воздействия (ФДТ выполнялась как на всем протяжении цервикального канала, так и на всей площади влагалищной порции шейки матки).
Плотность энергии лазерного излучения составляла 100–200 Дж/см2, плотность мощности — 250–400 мВт/см2.
Результаты исследования и обсуждение
Все пациентки имели нарушение нормальной микрофлоры влагалища, 30 из них были инфицированы ВПЧ ВКР.
Первым этапом лечения всех пациенток явилось выполнение им электроконизации шейки матки с последующим выскабливанием цервикального канала.
В послеоперационном периоде 22 пациенткам в качестве реабилитационного мероприятия с 3-го дня деструкции во влагалище вводился комбинированный препарат Депантол по 1 вагинальному суппозиторию 2 р./сут в течение 10 дней. Они составили опытную группу. В контрольной группе (20 пациенток) реабилитационных мероприятий после электроконизации шейки матки не проводилось.
Клинический мониторинг за репарацией поврежденной ткани осуществляли на 7-10-й день после деструкции и через 30 дней после вмешательства с помощью ОКТ-кольпоскопии. Микробиологическое исследование проводили через 30 дней после операции.
Динамическое наблюдение посредством ОКТ-кольпоскопии позволило определить, что эпителизация слизистой в послеоперационном периоде происходила под тонким струпом, который отторгался на 6-7-е сут в опытной группе и на 9-10-е сут — в контрольной группе. Отторжение струпа сопровождалось сукровичными либо незначительными кровянистыми выделениями, кровотечений не наблюдалось ни в одной из групп наблюдения. Полное замещение раневой поверхности МПЭ было отмечено на 3-4-й нед. после деструкции в опытной группе и на 5-6-й нед. — в контрольной группе пациенток.
Через 30 дней после операции всем пациенткам проводили контрольное исследование микрофлоры влагалища. Нормальные показатели отмечены у всех женщин опытной группы. В контрольной группе у 5 (25%) пациенток имелись различные нарушения биоценоза влагалища, в связи с чем требовалось назначение лечения.
Следует отметить, что всеми пациентками отмечена хорошая переносимость препарата Депантол.
Так, при назначении комбинированного препарата Депантол в послеоперационном периоде после электроконизации шейки матки отмечается выраженный профилактический противовоспалительный эффект и, как следствие, сокращение сроков регенерации поврежденной ткани на 2 нед. в опытной группе пациенток.
После получения результатов гистологического исследования операционного материала пациентки были разделены на 2 группы. В 1-ю группу вошли 27 женщин с отсутствием в краях резекции каких-либо эпителиальных изменений, характерных для ВПЧ-инфицирования, из них с диагнозом ЦИН II — 3 больные, ЦИН III — 20, с-r in situ — 4 пациентки. Лечение этих пациенток не включало проведения ФДТ.
При осмотре данных пациенток через 6 и 12 мес. после электроконизации цитологических и ОКТ-кольпоскопических данных, свидетельствующих о рецидиве, выявлено не было.
2-ю группу составили 15 пациенток с положительным по наличию ВПЧ-ассоциированных эпителиальных изменений краем резекции, из них у 7 определялись гистологические признаки ВПЧ-ассоциированных изменений МПЭ в виде папилломатозной гиперплазии, акантоза, дискератоза, нарушения стратификации МПЭ, наличия койлоцитов, у 5 выявлены ЦИН I, у 2 — ЦИН II.
Важно заметить, что морфологические заключения в 80% случаев во 2-й группе (12 пациенток) были прогнозируемы по скоростной ОКТ.
В 100% случаев обнаружения в крае резекции «ЦИН III минус» сомнительные и доброкачественные ОКТ-характеристики позволяли исключить инвазивный процесс, что являлось определяющим в одном клиническом случае, когда лечебная тактика была выбрана на основании ОКТ.
Данной пациентке на первом этапе была выполнена технически максимальная эксцизия, несмотря на невозможность определения планируемого эктоцервикального края резекции из-за обширности поражения, но отсутствовали данные об инвазии по скоростной ОКТ. В крае резекции была гистологически верифицирована ЦИН III, что было прогнозируемо.
Всем пациенткам 2-й группы с целью воздействия на клинические и субклинические формы ПВИ, а в последнем клиническом случае — с целью воздействия на нерезецированные очаги ЦИН, вторым этапом после деструкции выполнялась ФДТ. Выбор этого метода лечения у контингента больных фертильного возраста обусловлен максимальной возможностью сохранения архитектоники шейки матки, что является несомненным преимуществом перед проведением повторных эксцизионных процедур.
Реакция патологических очагов цервикального эпителия на ФДТ регистрировалась уже к концу сеанса лечения в виде отека и субэпителиальных кровоизлияний. На протяжении 1-й нед. происходило нарастание некротических изменений в зоне светового воздействия. Максимальная глубина и выраженность некроза, а также образование плотных фибриновых пленок, частично закрывающих просвет шеечного канала, обычно наблюдались к концу 2-й нед. после ФДТ. Постепенное очищение слизистой оболочки шейки матки от некротических тканей с четко визуализируемой границей между зоной эпителизации после ФДТ и плоскоэпителиальным покровом вне зоны светового воздействия завершилось к 3-4-й нед. после лечения. С учетом вышеизложенной оптимизации эпителизации при использовании Депантола после электроконизации препарат назначался всем пациенткам с 28-го дня после проведенного сеанса ФДТ по 1 суппозиторию 2 р./сут в течение 10 дней.
Мониторинг эффективности ФДТ осуществлялся путем проведения ОКТ-кольпоскопического, цитологического, вирусологического исследований после полного заживления шейки матки, затем каждые 4 мес. Сроки наблюдения составили 18 мес.
Полная или частичная регрессия ВПЧ-ассоциированных эпителиальных изменений достигнута у всех больных, причем с течением времени установлена тенденция их изменений на менее выраженную степень. Так, у пациентки с наличием в крае резекции ЦИН III в. динамике наблюдения к 12 мес. после 2-этапного лечения, по данным гистологического обследования биоптата, не было данных, свидетельствующих о ЦИН.
Следует обратить внимание на высокие показатели противовирусного эффекта ФДТ (по данным неоднократных исследований методом ПЦР), полная эрадикация ВПЧ достигнута у 12 женщин из 2-й группы.
Механизм противовирусного действия, вероятно, объясняется селективным накоплением ФС в клетках, инфицированных ВПЧ, с последующим их разрушением до базальных и парабазальных клеточных слоев вследствие прямого фототоксического и деструктивного лазерного воздействия.
Заключение
Таким образом, проведенные исследования показывают, что ОКТ в новой скоростной модификации делает возможным уточнение кольпоскопических картин, а использование цервикальной линейки оптимизирует планирование зоны резекции. Это позволяет при наличии обширных анормальных кольпоскопических картин, но отсутствии злокачественных ОКТ-данных в значительно отдаленных от наружного зева зонах эктоцервикса для сохранения архитектоники шейки матки выполнить максимально щадящее эксцизионное вмешательство.
Нами установлено, что включение комбинированного препарата Депантол в виде вагинальных суппозиториев в комплекс лечебных мероприятий после деструктивных вмешательств на шейке матки позволяет оптимизировать сроки реабилитации пациенток за счет выраженного профилактического противовоспалительного эффекта и, как следствие, путем ускорения регенерации поврежденных тканей.
В наших исследованиях также показана эффективность использования ФДТ у пациенток при наличии положительных ВПЧ-ассоциированных эпителиальных изменений в крае резекции после органосохраняющих операций, что можно объяснить его выраженным противовирусным эффектом, который связан с точечным воздействием на мультифокальные очаги вирусного поражения при клинической, субклинической и латентной формах ПВИ.
Данный метод обладает несомненным преимуществом перед проведением повторных эксцизионных процедур и является практически единственной возможностью предупреждения рецидивов цервикальной эпителиальной патологии при технически невозможной повторной конизации шейки матки.
Очевидно, что ФДТ у женщин репродуктивного возраста после эксцизии шейки матки снижает (а, возможно, и исключает) вероятность рецидивов интраэпителиальных неоплазий, а в итоге — предупреждает развитие РШМ.
Литература