Иксодовые клещи — переносчики многих микроорганизмов. До недавнего времени в России было известно несколько инфекций, передающихся иксодовыми клещами, такие как клещевой энцефалит и иксодовые клещевые боррелиозы. В 1998 г. у клещей обнаружены моноцитарные эрлихии, а у пациентов был впервые верифицирован моноцитарный эрлихиоз человека, а в 2002 г. выявлен возбудитель еще одного заболевания, передающегося клещами — анаплазмоза.
Наличие единого механизма передачи инфекций, общих хозяев и переносчиков возбудителей определяют существование сочетанных очагов природно-очаговых инфекций: клещевого энцефалита (КЭ), иксодовых клещевых боррелиозов (ИКБ), моноцитарного эрлихиоза человека (МЭЧ) и гранулоцитарного анаплазмоза человека (ГАЧ).
Биология возбудителей инфекций человека, связанных с клещами, сегодня находится в процессе активного изучения. Каждый и возбудителей после проникновения в организм человека занимает свою «экологическую нишу»: вирус КЭ, поступающий с жидкой слюной клеща в кровоток, поражает нервную систему, начальный период размножения боррелий происходит в кожном покрове, эрлихии и анаплазмы являются паразитами клеток крови — лейкоцитов. Кроме того, могут развиваться сложные патологические процессы, обусловленные одновременным попаданием в организм различных микробов.
Инфекции, передающиеся клещами, имеют довольно много сходных клинических черт, особенно в начале заболевания.
Любое заболевание, возникающее после укуса клеща, может быть моно — или смешанной инфекцией, вызванной одним, двумя или даже тремя микроорганизмами. С апреля по октябрь при обращении к врачу людей, пострадавших от укусов клещей или после посещения леса, необходимо обследовать на весь комплекс заболеваний, возбудители которых передаются клещами.
БОЛЕЗНЬ ЛАЙМА ИЛИ ИКСОДОВЫЙ КЛЕЩЕВОЙ БОРРЕЛИОЗ
– это природно-очаговое заболевание, переносчиком которого являются клещи. Наибольшая часть территорий с природными очагами боррелиоза находится в России, на этих же территориях распространен клещевой энцефалит.
Число выявляемых случаев заболевания боррелиозом растет по мере совершенствования лабораторной диагностики и улучшения информированности врачей и населения. Установлено, что число зарегистрированных больных в 5-10 раз меньше реальной заболеваемости. Неполное выявление больных приводит к увеличению числа больных с хроническим течением заболевания.
По городу Краснодару в эпидемический 2016 года зарегистрировано рекордное (77) количество случаев заболеваний болезнью Лайма за последние 5 лет. Показатель заболеваемости клещевым боррелиозом вырос в 2,2 раза по сравнению с 2012 годом и составил 8,4 на 100 тысяч населения. Среди заболевших — дети до 17 лет составили 2,6% или 2 случая ( и.п. 1,2), что говорит о высокой степени стойкости и активности природного очага клещевых инфекций.
В 2016 году по сравнению с 2012 годом отмечался рост обращаемости по поводу присасывания клещей в 4 раза, (с 347 до 1391 случая), в том числе в 9 раз у детей до 17 лет – ( с 50 до 546 сл.)
По данным энтомологических наблюдений, в последние годы произошел рост численности клещей в природных очагах клещевого боррелиоза, что косвенно подтверждается увеличением обращаемости населения по поводу укусов клещами.
В текущем году отмечается еженедельный прирост обращаемости населения города за медицинской помощью в связи с укусами клещей. За 3 месяца 2017 года по городу зарегистрировано 144 случая обращаемости за медицинской помощью, в том числе 60 детей, что превышает аналогичный период прошлого года на 61%, в том числе 45% среди детей. (89 случаев и 27 детей).
Присасывание клещей отмечается не только в природных условиях, но и в парках и скверах города.
Боррелиоз – заболевание с длительным хроническим течением, при котором поражаются многие органы и системы: кожа, нервная и сердечно-сосудистая системы, суставы, глаза, печень, селезенка и другие. Инкубационный период от 2 до 35 дней, в среднем – 2 недели.
В раннем периоде болезни (через 1-3 недели после укуса клеща), если произошло заражение, в месте укуса возникает покраснение кожи (пятно = эритема), которое постепенно расширяется до десятков сантиметров (от 5 -10 см и более) и обычно сохраняется долго (до 4-10 недель). У некоторых людей покраснение кожи не появляется вообще, и в этих случаях это серьезное заболевание трудно распознать. Также для раннего этапа заболевания характерно повышение температуры до 38-39оС, головная боль, боли в различных мышцах, суставах. Эти симптомы продолжаются 3-7 дней. В этот период возбудитель через кровь разносится в различные органы, где развивается воспаление. Чаще всего это сердце, суставы, глаза, уши, селезенка и лимфатические узлы. И поэтому больные обращаются к различным специалистам: невропатологам, ревматологам, дерматологам, и их ошибочно лечат как больных с дерматитом, радикулитом, менингитом, артритом.
В более поздний период болезни поражаются различные внутренние органы и системы: кожа, суставы, нервная системы, глаза. В связи с тем, что многие симптомы, характерные для клещевого боррелиоза, встречаются и при других заболеваниях, своевременное выявление этого заболевания возможно при обязательном лабораторном обследовании. При обнаружении лабораторией в клещах возбудителей боррелиоза необходимо обратиться к участковому врачу (терапевту, инфекционисту или педиатру) для назначения курса профилактического лечения. Раннее начало лечения позволяет сократить длительность течения болезни и предупредить развитие поздних стадий заболевания. На поздней стадии болезни лечение не всегда успешно, в частности, при поражении нервной системы.
Лабораторные исследования для выявления больных боррелиозом проводятся в лаборатории отделения особо опасных инфекций. Сыворотки крови для исследования на боррелиоз принимают как от лечебных учреждений, так и от граждан. Исследование крови на боррелиоз позволяет определить, произошло ли заражение после укуса клеща, а также освободился ли организм от возбудителя после проведенного лечения. В этих случаях забор крови производится через 20 дней от начала заболевания, или через 30-40 дней после укуса клеща.
Часто задаваемые вопросы.
Как передаются клещевые инфекции человеку?
Клещевые инфекции передаются в основном при укусах клещей (таежного или лесного) во время кровососания — отсюда и название инфекции. Таежный клещ обитает на востоке нашей страны – во всей таежной зоне Азии и Европы – от Камчатки и Северного Сахалина до восточных районов Ленинградской области (Приморский, Хабаровский края, Западная и Восточная Сибирь, Урал, северные районы Европейской части России, за исключением Крайнего севера). Лесной клещ живет на Европейской территории России — к западу от Волги, в Крыму, на Кавказе, в центральном регионе. У клещей возбудители инфекций передаются от самки потомству, поэтому среди них возбудители циркулируют постоянно.
Возможна передача возбудителей клещевых инфекций также контактным путем – через мелкие повреждения кожи (при раздавлении клеща, при расчесах), а также пищевым путем – при употреблении сырого молока овец и коз, реже коров. От человека к человеку указанные инфекции не передаются! Кошки и собаки могут болеть боррелиозом!
Когда больше вероятность заражения клещевыми инфекциями?
Больше всего человек подвержен укусам клещей весной и в первой половине лета, когда активность клещей самая высокая. Начало сезона зависит от погодных условий. При ранней, теплой весне укусы клещей регистрируются уже в конце марта. Однако в отношении клещевого энцефалита нюанс заключается в том, что в весенний период количество вируса в клещах чаще невысокое вследствие того, что вирус клещевого энцефалита очень плохо переносит резкие смены температур, особенно ее переходы через 00С. Поэтому во второй половине лета или в осенний период, несмотря на то, что вероятность укуса клеща ниже, вероятность развития тяжелой формы при этом более высокая за счет накопления большего количества вируса.
Клещи остаются активными в течение суток, но в солнечные дни их наибольшая агрессивность отмечается с 8 до 11 ч, заметно снижается в дневное время и снова возрастает в период с 17 до 20 ч. В пасмурные дни и во время теплого моросящего дождя их способность к нападению остается примерно на одном уровне. В очень жаркие дни и во время сильного дождя их активность резко падает.
В каких местах выше риск столкнуться с клещами?
Большинство природных мест обитания клещей находятся в лесных массивах, реже среди мелкого леса и вырубок, в хвойных лесах и лесостепных зонах. Клещи любят влажные места, поэтому их численность в таких местах наиболее велика. Много клещей обитает на дне лесных оврагов, а также по лесным опушкам, в зарослях ивняков по берегам лесных ручейков, а также вдоль лесных опушек и по заросшим травой лесным дорожкам. Клещи также обнаруживаются в лесах промышленного назначения, на берегах водохранилищ, заповедниках и даже в городских парках. Они способны чувствовать запах человека или животного на расстоянии около 10 м, и концентрируются в тех местах, где часто бывают животные и люди (места водопоев, лесные тропы).
Как защититься от укуса клеща?
Клещи не взбираются на растения на большую высоту (не более 1,5 м), они цепляются к одежде чаще в области ног и способны ползти только вверх. Поэтому при походе в лес или прогулках по местам с множеством кустарников и высокой травой необходимо приспособление носимой одежды таким образом, чтобы она максимально затрудняла прикрепление и проникновение клеща под одежду:
- желательно, чтобы одежда была гладкой и светлой (на светлом фоне клещей легче заметить);
- ворот и манжеты рубашки нужно плотно застегнуть, ее нижнюю часть заправить в брюки (для лучшего эффекта можно перевязать тесемками);
- нижнюю часть брюк заправить в сапоги или носки;
- использовать кофту или куртку с капюшоном с завязками или на резинке (для защиты шеи), при отсутствии капюшона – головной убор.
Рекомендуется применять акарицидные препараты – убивающие клещей («Гардекс аэрозоль экстрим» (Италия), «Гардекс антиклещ», «Фумитокс-антиклещ» и др.). Акарицидными препаратами обрабатывают только одежду (брюки – в области голеней, куртку или рубашку – нижнюю часть, область ворота, а также манжеты рукавов).
На поиск места прикрепления и прикрепление клеща может уходить до 1-2 часов, но необходимо отметить тот факт, что самцы клещей, в отличие от самок, питаются кровью более короткое время (несколько часов) и затем самостоятельно отпадают — таким образом, укус клеща-самца может остаться незамеченным. Поэтому во время пребывания в лесу необходимо проводить беглые само- и взаимоосмотры через каждые 15-30 минут.
При выходе из леса или ночевке в лесу нужно производить тщательный осмотр с раздеванием. При осмотре следует особо обращать внимание на волосистые части тела, кожные складки, ушные раковины, подмышечные и паховые области, грудь (наиболее частые места присасывания клещей), а в одежде – складки и швы. Тщательному осмотру подлежат все предметы, выносимые из леса, а также животные. При возможности для пикника или ночлега на природе выбирайте открытые места с минимально выраженным травяным покровом и кустарниками или практически полностью лишенные их.
- В случае зараженности клеща боррелиями нужно обратиться в поликлинику по месту жительства к терапевту или инфекционисту, при этом назначается профилактический прием антибиотиков.
Лечение иксодового клещевого боррелиоза должно проводиться в инфекционной больнице, где, прежде всего, проводится терапия, направленная на уничтожение боррелий, — при этом наступает полное выздоровление. В противном случае болезнь прогрессирует, переходит в хроническое течение, а в ряде случаев приводит к инвалидности.
— Если клещ не был проверен на зараженность клещевыми инфекциями, то необходимо незамедлительно обращаться в лечебное учреждение;
— Если впервые дни или недели после посещения леса у Вас повышается температура, Вы чувствуете недомогание и слабость, которые не связаны с простудой – обязательно обратитесь к врачу.
Понятие о трансмиссивных болезнях
Паразитарные болезни (паразитозы) подразделяются на группы в зависимости от возбудителя:
- протозоозы (возбудители протисты);
- гельминтозы (возбудители паразитические черви-гельминты);
- акаринозы (возбудители клещи);
- инсектозы (возбудители насекомые).
Зоонозы – это болезни, возбудители которых передаются от животного к животному. От животных может заражаться и человек (пример: чума птиц и млекопитающих).
Антропонозы – это болезни, возбудители которых передаются только от человека к человеку (корь, скарлатина).
Трансмиссивными называются болезни, возбудители которых передаются через кровь переносчиком – членистоногим (клещи и насекомые).
Переносчики могут быть механические и специфические.
Механические переносчики (мухи, тараканы) переносят возбудителей на покровах тела, на конечностях, на частях ротового аппарата.
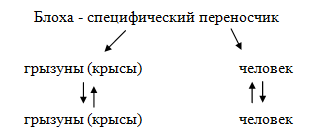
В организме специфических переносчиков возбудители проходят определенные стадии развития (малярийные плазмодии у самки малярийного комара, чумная палочка в организме блохи). Передача возбудителя болезни переносчиком происходит при кровососании через хоботок (инокуляция), через загрязнения покровов хозяина экскрементами переносчика, в которых находится возбудитель (контаминация), через яйца при половом размножении (трансовариально).
При облигатно-трансмиссивной болезни возбудитель передается только переносчиком (пример: лейшманиозы).
Факультативно-трансмиссивные болезни (чума, туляремия, сибирская язва) передаются через переносчика и другими способами (через органы дыхания, через продукты животного происхождения).
Трансмиссивная болезнь характеризуется наличием:
- паразита – возбудителя;
- позвоночного – хозяина;
- членистоногого – переносчика.
Природный очаг и его структура
В 1940 году Е.Н. Павловский, объединив данные паразитологии, экологии и эпидемиологии, сформулировал учение о природной очаговости болезней. Природно-очаговые болезни связаны с комплексом природных условий и существуют в определенных биоценозах независимо от человека.
Природный очаг – это определенный географический ландшафт, в котором происходит циркуляция возбудителя от донора к реципиенту через переносчика.
Доноры возбудителя – это больные животные, реципиенты возбудителя – здоровые животные, которые после заражения становятся донорами.
Схема природного очага чумы
В природный очаг входят следующие компоненты:
- возбудитель болезни;
- переносчик возбудителя;
- донор возбудителя;
- реципиент возбудителя;
- определенный биотоп.
Конечный результат (исход) заражения реципиента в природном очаге зависит от степени патогенности возбудителя, отчастоты «нападения» переносчика на реципиента, от дозы возбудителя, от степени предварительной вакцинации.
Природные очаги классифицируют по происхождению и по протяженности (по площади):
По происхождению очаги могут быть:
- природные (очаги лейшманиоза и трихинеллеза);
- синантропные (очаг трихинеллеза);
- антропургические(очаг западного клещевого энцефалита в Беларуси);·смешанные (совмещенные очаги трихинеллеза – природный + синантропный).
Очаги по протяженности:
- узко ограниченные (возбудитель встречается в гнезде птицы или в норе грызуна);
- диффузные (вся тайга может быть очагом клещевого энцефалита);
- сопряженные (в одном биотопе встречаются компоненты очагов чумы и туляремии).
Медицинское значение членистоногих
- Переносчики возбудителей болезней (механические и специфические).
- Возбудители болезней(клещ чесоточный, вши)
- Промежуточные хозяева гельминтов (двукрылые насекомые – для филярий, блохи – для некоторых ленточных червей).
- Ядовитые животные (скорпионы пауки, осы, пчелы).
Членистоногие как компоненты природных очагов
Отряд Acari – клещи Семейство Ixodidae-иксодовые клещи
Представители: Ixodesricinus – клещ собачий, Ixodes persulcatus – клещ таежный, Dermacentor pictus, Dermacentor marginatus.
Размеры тела иксодовых клещей от 5 до 25 мм.Обитают на открытых пространствах (влесах). Тело не имеет отделов. Ходильных конечностей – 4 пары. Первые две пары конечностей образуют ротовой аппарат – «головку». На спинной стороне имеется хитиновый щиток, который покрывает у самца всю дорзальную часть, у самок – только переднюю часть. У клещей рода Ixodes щиток темно-коричневый, у клещей рода Dermacentor он имеет мраморный рисунок. «Головка» видна со спинной стороны. Имеются глаза.
Клещи семейства Ixodidae
Особенности биологии. Кровососание длится до нескольких дней. Способны голодать до 3-х лет. «Укусы» клещей безболезненны, так как слюна содержит анестезирующие вещества. Самка откладывает до 17000 яиц.
Стадии развития:
яйцо → шестиногая личинка (отсутствуют стигмы, трахеи и половое отверстие) → несколько стадий нимф (недоразвита половая система) → имаго.
На каждой стадии происходит кровососание, поэтому цикл развития называется гонотрофическим.
Медицинское значение: они являются специфическими переносчиками возбудителей весенне-летнего и таежного энцефалита. Вирус энцефалита поражает слюнные железы и гонады клещей; передача возбудителя возможна при кровососании (инокуляция) и через яйца (трансовариально). К энцефалиту восприимчивы козы, поэтому возможна передача вируса через козье молоко. Резервуары вируса энцефалита – птицы, дикие грызуны. Иксодовые клещи переносят геморрагические лихорадки (поражение стенок кровеносных сосудов, почек, системы свертывания крови), бруцеллез, клещевой сыпной тиф, поддерживают очаги чумы и туляремии. Клещи рода Dermacentor переносят возбудителя шотландского энцефалита (вирусная вертячка овец), при котором поражается мозжечок; встречается и у человека.
Семейство Argasidae – аргазовые клещи
Представитель: Ornithodorus papillipes – клещ поселковый. Размеры тела клеща от 2 до 30 мм. Хитиновый щиток отсутствует.
«Головка» со спинной стороны не видна. Имеется краевой рант. Органы зрения отсутствуют.
Клещи семейства Argasidae
Аргазовые клещи – убежищные формы (пещеры, норы грызунов, заброшенные постройки человека). Места обитания – зона степей, лесостепей, полупустынь.
Особенности биологии: кровососание длится до 50 минут. Голодать могут до 12-15 лет. Яйцекладка содержит 50-200 яиц. Возможна трансовариальная передача возбудителей болезней.
Медицинское значение: специфические переносчики клещевого возвратного тифа (клещевой спирохетоз). Природные резервуары возбудителя – кошки, собаки, дикие грызуны. Инкубационный период заболевания составляет 6-8 дней. Слюна клещей обладает токсическим действием, и на месте укуса образуются стойкие язвы. Укусы клещей могут быть причиной смерти ягнят и овец.
Семейство Gamasidae — гамазовые клещи
Представитель: Dermanyssus gallinae — куриный клещ.
Размеры тела 0,2 – 0,3мм. Тело покрыто щетинками. Глаза отсутствуют. Поселяются в норах грызунов, в гнездах птиц. Являются постоянными или временными эктопаразитами. Для человека опасны клещи голубей, которые могут попадать в жилые помещения. Слюна клещей ядовита и вызывает развитие дерматитов. Переносят возбудителей клещевых спирохетозов, энцефалита, геморрагических лихорадок. Могут передавать возбудителей чумы и туляремии.
Отряд Anoplura – вши
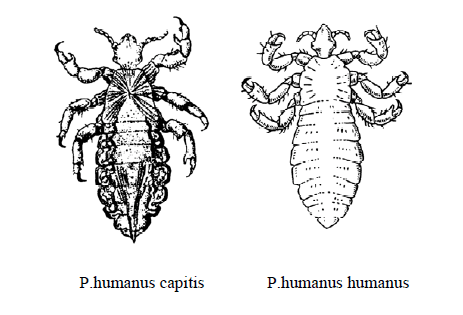
Представители: Pediculus humanus — вошь человека.
Вид P.humanus имеет два подвида: P.humanus capitis – вошь человека головная и P.humanus humanus – вошь человека платяная.
Яйца вшей называются гниды. Вошь головная липким секретом приклеивает их к волосам, вошь платяная – к ворсинкам одежды. Развитие с неполным метаморфозом. Личинка похожа на взрослую особь. Длительность жизни вши головной до 38 дней, вши платяной – до 48 дней. Вши головная и платяная являются специфическими переносчиками сыпного и возвратного тифов (вшивые тифы). Восприимчивость человека к вшивым тифам абсолютная.
Головная и платяная вошь
Возбудитель сыпного тифа – риккетсия Провачека – размножается в эпителиальных клетках желудка вши и выделяется с экскрементами переносчика. Заражение человека происходит при втирании в ранку от укусов экскрементов паразита при расчесах (контаминация). После перенесенного заболевания у человека вырабатывается стойкий иммунитет.
Возбудитель возвратного тифа – спирохета Обермейера – с кровью больного из желудка вши проникает в полость тела. Заражение человека происходит при раздавливании вши и втирании ее гемолимфы в кожу при расчесах (специфическая контаминация). Иммунитет после заболевания не вырабатывается и возможны рецидивы болезни.
Болезнь, которую вызывают вши рода Pediculus, называется педикулез (или «болезнь бродяг»). Слюна вшей вызывает зуд, у особо чувствительных людей – повышение температуры тела. Характерными для педикулеза являются пигментация и огрубение кожи. Осложнения педикулеза – экзема, конъюнктивит, колтун (поражение волосистой части головы).
Отряд Aphaniptera – блохи
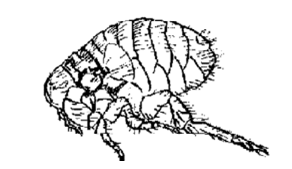
Представители: блохи рода Oropsylla и Xenopsylla (крысиные блохи) Pulex irritans – блоха человеческая
Блохи – временные эктопаразиты. Имаго питаются кровью человека и животных, личинки – органическими остатками. Сплюснутое с боков тело блохи покрыто плотным хитином и множеством волосков и щетинок. На голове – короткие усики и простые глаза. Ротовой аппарат колюще-сосущего типа.
Блоха человеческая (Pulex irritans)
Развитие идет с полным метаморфозом. Личинки развиваются в щелях пола, в пыльных углах. Срок развития – 19 дней.
Крысиные блохи являются специфическими переносчиками чумы, переносят туляремию, крысиный сыпной тиф. Блохи являются промежуточными хозяевами крысиного и собачьего цепней. Очаги чумы сохраняются в Индии, Пакистане и Бирме. Природные очаги чумы поддерживаются дикими грызунами. Восприимчивость человека к чуме абсолютная. Природными резервуарами чумы являются различные дикие грызуны – крысы, суслики, сурки и др. Чумная палочка размножается в желудке блохи, образуя «чумной блок», который закрывает его просвет. Кровь отрыгивается при кровососании в ранку вместе с бактериями.
Отряд Diptera – двукрылые.
Передняя пара крыльев – перепончатые прозрачные, вторая пара превратилась в небольшие придатки – жужжальца – орган управления полетом. На голове расположены большие фасеточные глаза. Ротовой аппарат лижущий, сосущий или колюще-сосущий.
Семейство Muscidae – мухи
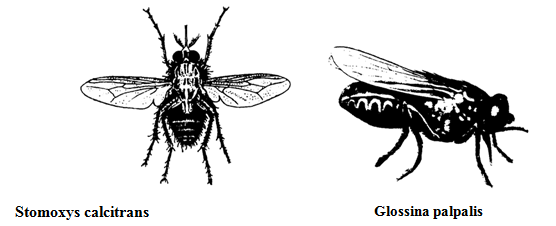
Stomoxys calcitrans – осенняя жигалка.
Осенняя жигалка и муха це-це
Хитиновыми зубцами хоботка соскабливает эпидермис и слизывает кровь. Ее слюна содержит ядовитые вещества и вызывает сильное раздражение. Укусы жигалки болезненны. Наибольшая ее численность – в августе-сентябре. Осенняя жигалка переносит возбудителей сибирской язвы, туляремии, стафилококковые инфекции.
Glossina palpalis – муха це-це – специфический переносчик трипаносом сонной болезни. Питается кровью человека и животных. Живородяща. Размеры тела до 13 мм. Встречается только в западных районах Африки.
Семейство Tabanidae – слепни.
Крупные мухи (до 3 см). Самцы питаются соками растений, самки – кровью человека и животных. Слюна ядовита и на месте укуса образуется опухоль. Развитие с метаморфозом, проходит на дне водоема или во влажной почве. Слепни – механические переносчики возбудителей туляремии и сибирской язвы, промежуточные хозяева и специфические переносчики лоаоза.
Слепень (Tabanidae)
Семейство Simuliidae – мошки.
Размеры тела от 2 до 6 мм. Развитие проходит в воде. Самки питаются кровью. Слюна мошек токсична. Укусы болезненны. Мошки — переносчики туляремии и онхоцеркоза.
Мошка (Simuliidae)
Семейство Сeratopogonidae – мокрецы.
Размеры тела 1-2,5 мм.
Самки питаются кровью. Развитие проходит во влажной почве и небольших стоячих водоемах. Мокрецы переносят туляремии и некоторых возбудителей филяриатозов. Участвуют в передаче вируса японского энцефалита.
Мокрец (Сeratopogonidae)
Семейство Phlebotomidae – москиты.
Размеры тела 1,5 – 3,5 мм.
Яйца откладывают в норах грызунов, гнездах птиц, в пещерах, в мусоре. Самцы питаются соками растений, самки – кровью. Слюна ядовита. Укусы болезненны, на их месте развиваются язвенные дерматиты. Москиты – специфические переносчики лейшманиозов и лихорадки паппатачи (трансовариальная передача). Переносят также желтую лихорадку и филяриатозы.
Москит (Phlebotomidae)
Семействo Culicidae – комариные.
Наиболее распространены представители родов Anopheles, Culex, Aedes. Ротовой аппарат у самцов сосущий, они питаются нектаром цветов. Ротовой аппарат самок колюще-сосущий, они питаются кровью. Развитие проходит в небольших водоемах, с полным метаморфозом. Созревание яиц происходит после кровососания во время переваривания крови (гонотрофический цикл). Комары – временные эктопаразиты человека и животных. Они переносят до 50 различных заболеваний. Комары р.Anopheles – специфические переносчики и окончательные хозяева возбудителей малярии – малярийных плазмодиев, также переносят возбудителей филяриатозов.
Комары (Culicidae)
А – р. Anopheles, Б – р. Culex
Комары р.Culex переносят энцефалит, японский туляремию, вухерериоз; комары рода Aedes – туляремию, желтую лихорадку, лихорадку Денге, японский энцефалит, сибирскую язву, вухерериоз. Укусы комаров болезненны и вызывают сильный зуд.
Биологические основы профилактики трансмиссивных и природно-очаговых болезней
Кровососущие членистоногие наносят значительный вред здоровью человека, уносят огромное количество жизней. По выражению академика Е.Н. Павловского «хоботки комаров, вшей, блох убили людей больше, чем их погибло в сражениях, имевших когда-либо место». Значительный урон терпит от них и сельское хозяйство.
Большое значение имеет разработка и проведение мер борьбы с кровососущими членистоногими.
А. Биологические меры борьбы: использование их природных «врагов». Например: разводят рыбку гамбузию, которая питается личинками малярийного комара.
Б. Химические меры борьбы: использование инсектицидов (против мух, тараканов, блох); обработка мест, где зимуют комары и мелкие кровососы (подвалы, сараи, чердаки); закрытые мусоросборники, туалеты, навозохранилища, удаление отбросов (против мух); распыление в водоемах ядохимикатов, если они не представляют хозяйственной ценности (против комаров); дератизация (против клещей и блох).
В. Индивидуальные меры защиты от кровососущих членистоногих: защитные жидкости, мази, специальная закрытая одежда; чистота в помещениях, влажная уборка; засечивание окон жилых помещений; чистота тела и одежды.
Вестник РУДН. Серия: МЕДИЦИНА
RUDN Journal of MEDICINE
2018 Vol. 22 No. 3 322-331
ИММУНОЛОГИЯ. ИНФЕКЦИОННАЯ ПАТОЛОГИЯ
DOI: 10.22363/2313-0245-2018-22-3-322-331
ГРАНУЛОЦИТАРНЫЙ АНАПЛАЗМОЗ ЧЕЛОВЕКА
Ю.А. Климова, Н.А. Половинкина, В.В. Коннов, Д.С. Коннов
Российский университет дружбы народов, Москва, Россия
Природно-очаговые трансмиссивные клещевые инфекции имеют широкое распространение в мире и характеризуются большим этиологическим разнообразием. Гранулоцитарный анаплазмоз человека (ГАЧ) — трансмиссивное заболевание, также передающееся через укус клещей, стало актуальным с конца прошлого века после его выявления не только у животных, но и у человека. В данном обзоре представлена информация о заболеваемости ГАЧ в России и в мире, распространенности ареала обитания клещей-переносчиков, о разнообразии резервуаров и источников инфекции, механизмах и путях передачи возбудителя, биологических особенностях возбудителя заболевания Anaplasma phago-cytophilum. Подробно рассмотрены звенья и стадии патогенеза болезни. Приведены научные данные об особенностях клинического течения заболевания, о частоте и разнообразии различных симптомов болезни. Обсуждаются вопросы лабораторной и дифференциальной диагностики анаплазмоза и его место в нозологической структуре у пациентов с лихорадкой неясного генеза. При выборе метода лабораторной диагностики нужно учитывать, что молекулярно-генетический метод (полимеразная цепная реакция ПЦР-диагностика) позволяет быстро подтвердить диагноз, а серологические методы исследования в большей степени — поставить ретроспективный диагноз. Представлены актуальные данные по лечению болезни и методам профилактики ГАЧ. В статье также приводятся результаты собственных наблюдений авторов на основе обследования 63 пациентов. Проведен анализ случаев обращения жителей г. Москвы по поводу присасывания клещей и обобщены показатели заболеваемости инфекциями, передающимися иксодовыми клещами. Для диагностики ГАЧ и других клещевых лихорадок использовали метод полимеразной цепной реакции.
Выявлено, что в г. Москве среди ассоциированных с клещами инфекций лидирующее место занимает Лайм-бор-релиоз (60%), а доля гранулоцитарного анаплазмоза человека составляет только 5% больных. Вместе с тем выявлено, что исследование клещей на присутствие у них возбудителей ГАЧ и других природно-очаговых клещевых инфекций проводится в недостаточном объеме (менее 30%), что необходимо учитывать при клинической и лабораторной дифференциальной диагностике, а также проведении профилактических мероприятий.
Ключевые слова: Гранулоцитарный анаплазмоз человека, ГАЧ, возбудитель Anaplasma phagocytophilum, симптомы, диагностика
Ответственный за переписку:
Гранулоцитарный анаплазмоз человека (ГАЧ, англ. Human granulocytotropic anaplasmosis, HGA) — трансмиссивное заболевание, ставшее актуальным с конца прошлого века после его выявления не только у животных, но и у человека. Наибольшее число случаев отмечается в Соединенных Штатах Америки, однако с каждым годом зона выявления клещей-переносчиков расширяется, число зарегистрированных случаев болезни в различных странах мира растет.
РАСПРОСТРАНЕНИЕ
В США с 1995 года зарегистрировано более 15 952 случаев этой болезни, число их неуклонно растет с каждым годом . Анаплазмоз выявлен в Азии, в частности в Китае, Японии . Встречаются сообщения об этой инфекции в Австралии. В России первые данные об этой болезни появились в 2002 году . На территории нашей страны ГАЧ выявляют практически повсеместно: Горном Алтае, Иркутской области, на Дальнем Востоке, Тюменской области, Омской и Томской, Воронежской, Тульской областях, в Красноярском крае и многих других территориях . С января 2013 года приказом Рос-стата РФ от 20.12.2012 № 645 утверждена статистическая отчетность по форме № 1 дополнительно по ГАЧ. За 2016 год в Российской Федерации было выявлено 53 случая ГАЧ . C 16 марта 2017 года во всех федеральных округах России проводится еженедельный мониторинг за инфекциями, передающимися клещами, в том числе ГАЧ. За неполный 2017 год сообщено о 21 случае ГАЧ в России.
ВОЗБУДИТЕЛЬ
Россия — один из самых больших в мире ареалов инфекционных заболеваний, передающихся клещами. Одно из них — гранулоци-тарный анаплазмоз человека (ГАЧ), возбудитель которого — Anaplasma phagocytophilum — был впервые описан у человека в 1990 году (ранее был известен в ветеринарии) и первоначально (до 2001 г.) был отнесен к эрлихиям (E. phago-
cytophila и E. equi), которые вызывают сходное по клиническим проявлениям трансмиссивное заболевание. Анаплазма относится к семейству Anaplasmatacea, отряду Rickettsiale, имеет округлую форму, темную окраску, размножается делением, размер составляет в диаметре от 0,2 до 1,2 мкм. Возбудитель анаплазмоза является облигатным внутриклеточным паразитом, который развивается внутри гранулоцитов человека и животных в вакуолях, связанных с клеточной мембраной.
МЕХАНИЗМ ЗАРАЖЕНИЯ
Анаплазмоз является трансмиссивным заболеванием, в то же время возможна передача инфекции при реализации вертикального и контактного механизмов, при гемотрансфузиях. A. phagocytophilum сохраняет жизнеспособность в замороженной крови до 18 дней . Сезонность заболеваемости связана с периодами активности клещей-переносчиков.
Зона выявления клещей-переносчиков анаплазмоза постоянно расширяется. Многочисленные публикации свидетельствуют об обнаружении возбудителя этой болезни в клещах многих видов во многих странах мира. В Северной Америке чаще анаплазмоз регистрируется в США, где основным его переносчиком являются клещи Ixodes scapularis и I. pacificus . На севере этой страны до 53,0% взрослых клещей I. scapularis и до 20,6% нимф инфицированы A. phago-cytophilum. Возбудителя анаплазмоза обнаруживают в клещах-переносчиках в Канаде. В Европе заболевание впервые было зарегистрировано в Словении в 1996 году. Основным переносчиком анаплазмоза на этой территории является I. ri-cinus, уровень зараженности которого невысокий и варьирует от 1 до 5%. А на территории Италии этот показатель достигает 24,4% . В Эстонии, Белоруссии и Европейской части России носительство возбудителя анаплазмоза также было выявлено только у клещей вида I. ricinus. Уровень инфицированности клещей достигает 13,4% в европейской части России, 4,2% — в Белоруссии и 2,6% в Эстонии.
Для возбудителя анаплазмоза доказана трансфазовая, но не трансовариальная передача, что, в свою очередь, доказывает важную роль резервуара инфекции в сохранении и распространении анаплазмы в мире. Персистенция A. phagocytophi-lum выявлена у многих млекопитающих: овец, собак, крупного рогатого скота, лошадей, оленей, лесных мышей, рыжих полевок, косулей в различных странах Европы от Норвегии до Италии . Основным резервуаром возбудителя в США являются белоногие мыши и белохвостые олени. В Японии анаплазм выявляют у оленей и кабанов. В Африке резервуаром ГАЧ являются лошади. В России основным резервуаром является рыжая полевка .
ПАТОГЕНЕЗ
Начальная стадия заболевания обусловлена внедрением возбудителя в организм человека через кожу, при этом первичный аффект, как правило, отсутствует. В клеще-переносчике возбудитель размножается в слюнных железах и клетках кишечника. Со слюной клеща возбудитель проникает в подлежащие ткани кожи и распространяется гематогенным путем по всему организму. Анаплазмы инфицируют грануло-циты, в первую очередь зрелые нейтрофилы. Внутри цитозоля лейкоцитов формируются морулы — колонии зрелых бактерий, обладающие способностью избегать действия лизосом клетки . После размножения в цитоплазмати-ческой вакуоли происходит выход возбудителя с разрушением клетки. В инфекционный процесс вовлекаются также макрофаги селезенки, печени, лимфатических узлов, костного мозга и других органов, вызывая в них воспалительные изменения.
Наибольшее значение в развитии патологического процесса имеет белок мзр2, который обеспечивает прикрепление паразита к мембране клетки, а также отвечает за его изменчивость. Другой белок возбудителя ГАЧ, апкА, является единственным известным белком бактерии, обладающим способностью проникать через мем-
браны вакуоли и ядра, что позволяет ему располагаться около хроматина в ядре зараженного гранулоцита. Однако влияние его на транскрипцию генов хозяина требует дальнейшего изучения.
Имеются различия этого белка у возбудителей в зависимости от географической зоны распространения. Предполагают, что с ним связаны различия в тяжести течения болезни между североамериканским и европейским анаплазмозом .
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Отличия в тяжести клинической картины ГАЧ также связывают с развитием иммунопатологического ответа на стимуляцию 1КЫ-у клеток-эффекторов и недостаточное регуляторное воздействие 1Ь-10 .
При изучении механизмов инфекции у клещей-переносчиков и резервуаров заболевания было выявлено, что A. Phagocytophilum поддерживает длительность инфекции с помощью регуляции экспрессии генов хозяина, например, повышая способность к выживанию у клещей при низких температурах и подавляя апоптоз клеток желудочно-кишечного тракта у них. А у животных-резервуаров A. Phagocytophilum увеличивает потребление холестерина инфицированными клетками и направляет транспорт питательных веществ внутри клетки свою пользу .
КЛИНИКА И ОСЛОЖНЕНИЯ
Клинические проявления анаплазмоза в европейском регионе сходны с таковыми в США, но тяжесть течения болезни менее выражена, что, возможно, связано со степенью патоген-ности возбудителя . Большинство описанных случаев заболевания регистрируется у взрослых. Тяжесть болезни варьирует от легких до тяжелых форм. При этом у пожилых людей и пациентов с иммунодепрессией (ВИЧ и др.) болезнь протекает тяжелее. Инкубационный период составляет около двух недель. Клиника характеризуется полиморфизмом и напрямую зависит от возраста пациента и сопутствующей патологии.
Высыпания на коже различного характера (макулярные, макуло-папулезные, петехиальные) встречаются редко — лишь у 2,4% обследованных. Однако при обнаружении сыпи в первую очередь необходимо думать о сочетании ГАЧ с клещевым боррелиозом, клещевыми эндемическими риккетсиозами или даже менингококко-вой инфекцией .
Анаплазмоз может протекать с явлениями менингизма, а также менингита и менингоэнцефа-лита. Так, по данным Центра по контролю и профилактике заболеваний США, c 2000 по 2007 год было зарегистрировано 5 таких пациентов из 2040 больных, что составило 0,2% .
У иммунокомпрометированных пациентов анаплазмоз протекает тяжело с развитием различных осложнений, хотя смертность составляет менее 1% . У таких пациентов можно ожидать развитие инфекционно-токсического шока, острого респираторного дистресс-синдрома, проявлений различных инвазивных оппортунистических инфекций вирусной и грибковой этиологии, рабдомиолиза, панкардита, развития острой почечной недостаточности, кровотечений, развития полинейропатии, а также острой транзиторной сенсоневральной тугоухости .
В клиническом анализе крови в первые дни болезни отмечаются неспецифические изменения: лейкопения (55—60%) с палочкоядерным сдвигом влево на фоне нейтропении, лимфопения, тром-боцитопения (68—75%), которые исчезают к концу второй недели болезни, повышение СОЭ. Лим-фопения затем сменяется лимфоцитозом, появляются атипичные лимфоциты. Следует учесть, что нормальное количество лейкоцитов и тромбоцитов не являются доказательством отсутствия анаплазмоза у пациентов, лихорадящих более недели. И наоборот, у пациента с лихорадкой менее недели, сопровождающейся лейкоцитозом или тромбоцитозом, вероятность ГАЧ низкая
В зарубежных публикациях имеются сведения о поражении легких при анаплазмозе у взрослых больных, а по данным отечественных авторов и у детей, больных ГАЧ, при рентгенологическом обследовании органов грудной клетки практически в половине случаев выявляются инфильтративные уплотнения легочной ткани.
Исследования, проведенные в Китае, свидетельствуют о высоком уровне заболеваемости ГАЧ в этой стране и особенностях клинических проявлений болезни с наличием явлений гастроэнтерита, выраженной лимфаденопатии, относительной брадикардии, отечного синдрома и сопровождается более высокой смертностью по сравнению с таковой в странах Европы и Америки. Эти же данные доказывают возможность передачи возбудителя при непосредственном контакте с больным анаплазмозом. Кроме того, выявлен новый возбудитель болезни — А. сарга .
ДИАГНОСТИКА
Диагноз анаплазмоза представляет значительные трудности, так как клиника болезни неспецифична. Легче всего заболевание диагностируют при среднетяжелом или тяжелом течении болезни с учетом данных эпидемиологического анамнеза. Наибольшее число больных регистрируют в теплое время года, что соответствует периоду активности клещей. 75% больных, об-
следованных на анаплазмоз, указывают на присасывание клеща, и только у 2% из них диагноз ГАЧ был подтвержден. Учитывая особенности клинических проявлений анаплазмоза, дифференциальный диагноз необходимо проводить с инфекциями, передаваемыми клещами: болезнью Лайма, инфекцией, вызываемой Borrelia miyamotoi, бабезиозом, эрлихиозом, инфекцией, вызываемой вирусом Повассан, возвратной клещевой лихорадкой, вызываемой B. hermsii, а также другими инфекциями, вызванными энтеро-вирусами, ЭБВ, ГВЧ 6 типа, парвовирусом В19, вирусными гепатитами, лихорадкой Западного Нила, Чикунгунья.
Нами проведен анализ 63 случаев обращений пациентов по поводу присасывания клеща на территории Московской области и г. Москвы. Все пациенты — мужчины в возрасте 35—39 лет, жители г. Москвы. Сезонность обращения совпадала с периодом активности иксодовых клещей. Нападение клещей отмечалось не только в лесных массивах и на дачных участках в Московской области, но и в парках г. Москвы.
Признаки заболевания после укуса клеща наблюдались у 21 (33,3%) пациента, у 42 (66,7%) к моменту обращения к врачу они отсутствовали. У больных наблюдались слабо выраженные симптомы интоксикации и экзантема преимущественно по типу кольцевидной эритемы. Течение болезни было доброкачественным, симптомы быстро купировались после назначения антибиотиков группы тетрациклина. При первичном осмотре у всех больных заболевание расценивали как клещевой боррелиоз (КБ).
Исследованием клещей методом ПЦР на наличие ДНК Borrelia burgdorferi и серологическими анализами диагноз боррелиоза был подтвержден у 19 больных (30,1%). В двух случаях в клещах обнаружена ДНК Anaplasma phagocy-tophilum. В случаях, где после укуса не было никаких клинических проявлений, в 29 (46%) исследованиях доставленных клещей обнаружены ДНК B. burgdorferi, а ДНК A. phagocytophilum — только в одном случае. Всего диагноз боррели-
оза был подтвержден у 38 (60,3%) обратившихся за медицинской помощью, гранулоцитарного анаплазмоза — у 3 (4,7%), в 22 (35%) случаях результаты исследования клещей были отрицательными.
Таким образом, анализ проведенных нами наблюдений показал, что инфицированность иксодовых клещей в Московском регионе высокая — в 41 (65%) случае зарегистрированы положительные результаты.
В Москве и Московской области среди ассоциированных с клещами инфекций лидирующее место занимает клещевой боррелиоз, на долю ГАЧ приходится 4,7%. Клинически выраженные проявления клещевых инфекций к моменту обращения наблюдались у 21 (33,3%) пациента: КБ — у 19 человек, ГАЧ — у двух.
Сочетание ГАЧ с болезнью Лайма в странах Европы и Северной Америки по различным источникам составляет от 2 до 11,7%, протекает тяжелее, чем моноинфекция . В наших наблюдениях коинфекции ГАЧ с клещевым боррели-озом не установлено.
В дифференциальной диагностике анаплазмоза необходимо учитывать и другие бактериальные, протозойные и вирусные инфекции: гонококковую, менингококковую, микоплазменную инфекции, бактериальные эндокардиты, стрептококковую инфекцию группы А, вторичный сифилис, брюшной тиф, колорадскую клещевую лихорадку, МЭЧ, лептоспироз, крысиный сыпной тиф, Q лихорадку, содоку, лихорадку Скалистых гор, туляремию, лихорадку Денге, малярию, лептоспироз, клещевой энцефалит.
Из неинфекционных заболеваний сходные клинические симптомы имеют аллергические реакции, идиопатическая тромбоцитопеническая пурпура, иммунокомплексные заболевания, болезнь Кавасаки, гемафагоцитарный синдром. Не следует забывать о лейкемии, лимфоме, особенно если выявлены внутрицитоплазматические структуры (тельца Ауэра), которые весьма сходны с морулами.
Лабораторная диагностика на ранних стадиях болезни проводится путем микроскопии мазка крови или ее лейкоцитарной фракции, окрашенной по Райту или Романовскому—Гимза. На первой неделе заболевания у 20—80% пациентов в периферической крови обнаруживаются мору-лы, представляющие собой скопления возбудителя в цитоплазме нейтрофилов. Идентифицировать возбудителя возможно только в специализированных лабораториях, однако метод микроскопии может быть использован в предварительной диагностике .
Может быть использован бактериологический метод: возбудителя культивируют на средах из промиелоцитарных клеток, взятых у больных лейкемией (HL-60).
С первых дней болезни более надежным методом диагностики является определение ДНК возбудителя в крови с помощи ПЦР, чувствительность которой составляет 60—70%. Однако даже при отрицательном результате этой реакции, при соответствующей клинической картине, не следует отказываться от диагноза и назначения специфического лечения. Чувствительность ПЦР резко снижается на фоне антибиотикотерапии.
Золотым стандартом лабораторного подтверждения диагноза анаплазмоза считается реакция непрямой иммунофлюоресценции (РНИФ), с помощью которой определяется не только наличие или отсутствие антител, но и определяется их титр. Диагноз подтверждается выявлением четырехкратного нарастания титра антител классов IgM и IgG к A. phagocytophilum в парных сыворотках с интервалом 2—4 недели. В течение первой недели болезни в сыворотке крови антитела обоих классов, как правило, не определяются или присутствуют в незначительном количестве, в дальнейшем титры IgM и IgG в течение болезни растут одновременно. Результат учитывается по динамике иммуноглобулинов обоих классов. IgM-антитела менее специфичны, оценка результата РНИФ только по иммуноглобулинам этого класса в некоторых случаях может приводить к ложноположительному результату. Иммуногло-
булины класса М начинают появляться с 9—11-го дня болезни и достигают максимума на 12—24-й день заболевания. Затем их концентрация постепенно снижается. Антитела класса ^О достигают максимума в сыворотке крови к 4—5-й неделе заболевания . Далее титр их остается высоким длительное время, возбудитель в это время в крови не определяется . Серологическую диагностику осложняет наличие перекрестных реакций на анаплазмоз с моноцитарным эрлихиозом. Вследствие этого необходимо определять наличие антител к обоим возбудителям. В то же время регистрируются случаи серонега-тивного течения анаплазмоза.
Использование высокочувствительного им-муноферментного анализа (ИФА) для диагностики анаплазмоза менее эффективно, с его помощью определяется только качественный показатель, количественные изменения антител в парных сыворотках существующие тест-системы не определяют.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Гранулоцитарный анаплазмоз человека возможно подтвердить методом иммуногистохими-ческого исследования костного мозга, селезенки, лимфатических узлов, печени и легких .
При выборе метода лабораторной диагностики нужно учитывать, что ПЦР-диагностика позволяет быстро подтвердить диагноз, а серологические методы исследования в большей степени позволяют поставить ретроспективный диагноз. В связи с тем, что достаточно чувствительные и специфичные лабораторные тесты недоступны широкому кругу учреждений здравоохранения, лечение не стоит откладывать до лабораторного подтверждения диагноза. Дополнительные методы диагностики, такие как ультразвуковая и рентгенологическая, не играют ведущей роли, но позволяют определить вовлеченность тех или иных органов и тканей в инфекционный процесс.
Присасывание клещей и инфицирование может происходить в эндемичных зонах неоднократно, несмотря на это повторное заболевание встречается редко. Известно, что уровень сыво-
роточных антител к A. phagocytophilum у человека после выздоровления сохраняется повышенным в среднем около 12—18 месяцев, у некоторых — до 3 лет после инфекции. В эндемичных районах, проживание в которых является главным риском заражения, уровень серопозитивности населения прямо пропорционален возрасту обследованных. В литературе имеется сообщение о случае повторного заболевания спустя 2 года от первичного при снижении титра антител с 1 : 1280 до 1 : 80 . Данных о персистенции или рецидивирующем течении анаплазмоза у человека в настоящее время нет .
ЛЕЧЕНИЕ
В связи с трудностями лабораторного подтверждения диагноза анаплазмоза в ранние сроки болезни при соответствующих эпидемиологических и клинических предпосылках таким больным назначается эмпирическая специфическая терапия. Препаратами выбора для лечения при подозрении на ГАЧ считаются препараты тетра-циклинового ряда. Пациентам с подозрением на ГАЧ или с подтвержденным диагнозом анаплазмоза рекомендуется назначение доксицик-лина, который применяют перорально или внутривенно при отсутствии противопоказаний к использованию данного препарата. Доза докси-циклина для взрослых при пероральном приеме составляет 100 мг каждые 12 часов. Дети старше 8 лет получают дозу в соответствии с весом из расчета 4,4 мг/кг/сутки, максимальная разовая доза — 100 мг. Детям весом более 45 кг назначают взрослую дозу препарата. Улучшение наступает в первые 24—48 часов лечения. У детей старше 8 лет и взрослых продолжительность лечения составляет 10 дней, однако при ко-инфек-ции с B. burgdorferi курс терапии продолжается до 14 дней. У детей младше 8 лет с тяжелым течением анаплазмоза курс доксициклина составляет 4—5 дней (или до 3 дня после нормализации температуры тела), а в случае ко-инфекции с бор-релиозом лечение продолжается амоксициллином или цефуроксимом до 14 дней .
Рифампицин также обладает активностью in vitro против A. phagocytophilum. В литературе есть сообщения успешного опыта лечения нескольких беременных и детей, больных анаплазмозом. Поэтому пациенты, у которых не может быть использован доксициклин, могут получать рифампицин в дозе 10 мг/кг/сутки, максимальная разовая доза 300 мг в течение 7—10 дней. Взрослым (старше 18 лет) рекомендуется прием рифампицина в дозе 300 мг 2 раза в день в течение 5—7 дней. Есть данные об эффективности левофлоксацина в лечении этой патологии .
Прогноз заболевания и отдаленные последствия. После перенесенного заболевания рецидивов или хронического течения заболевания не регистрируется. Есть данные о возможности спонтанного выздоровления без антибактериальной терапии .
Летальность при ГАЧ по данным американских авторов составляет от 0,2% до 10%, при этом в госпитализации по тяжести течения нуждаются 36% заболевших, только у 3% наблюдается тяжелое течение заболевания. В Российской Федерации ГАЧ имеет в основном среднетяжелое течение, тяжелая форма регистрируется у 1,9% заболевших . Молекулярно-генетическими методами исследования (ПЦР) было доказано, что бактериемия при отсутствии лечения может сохраняется до 1 месяца. Тем не менее длительный прогноз благоприятен. Выявление повышенного уровня антител должно расцениваться как свидетельство перенесенной инфекции, нежели доказательство неизлеченного заболевания.
ПРОФИЛАКТИКА
Вакцинация не разработана. Главным способом защиты от ГАЧ является профилактика присасывания клещей и их немедленное удаление. Защите от клещей способствует ношение светлой одежды, рубашек с длинным рукавом, брюк, закрытой обуви. Важно использование репеллентов (пикиридин, диэтилтолуамид, пермет-рин), а также обработка территории проживания акарицидными средствами.
Возможность превентивного лечения док-сициклином для анаплазмоза пока достаточно не исследована. Считается, что химиопрофилак-тика доксициклином малоэффективна, профилактический прием этого препарата не предупреждает заболевание, а лишь удлиняет инкубационный период. В Великобритании тетрациклины пролонгированного действия используют для профилактики этого заболевания у животных.
ВЫВОДЫ
Таким образом, гранулоцитарный анаплазмоз человека (ГАЧ) является трансмиссивной широко распространенной инфекцией, в том числе и в России, недостаточно изученной, вызываемой Anaplasma phagocytophilum, одной из немногих бактерий, инфицирующих нейтро-филы. Относительно небольшой срок наблюдений со времени идентификации возбудителя и болезни и недостаточность достоверного фактического материала не позволяют в полной мере оценить роль гранулоцитарного анаплазмоза в патологии человека: распространении, эпидемическом процессе, патогенезе и иммунном ответе, способности вызывать клиническое течение болезни разной степени тяжести у человека и субклиническое состояние у животных-резервуаров. Остаются невыясненными патогенетические механизмы и последствия нейтрофильной инфекции, причины различий клинического течения и степени тяжести заболевания на разных территориях, особенности клинического течения ГАЧ у детей и беременных, подходы к их лечению.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Bakken J.S., Dumler S. Human granulocytic anaplasmosis // Infect Dis Clin North Am. 2015 Jun; 29(2): 341—355.
6. Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека. Письмо от 26 февраля 2014 года № 01/2079-14-32 «Об эпидемиологической ситуации по КВЭ и другим инфекциям, передающимся клещами, в 2013 году на территории Российской Федерации и прогнозе на 2014 год».
7. URL: https://www.uptodate.com/contents/human-ehrlichiosis-andanaplasmosis.
10. Blanco J.R., Oteo J.A. Human granulocytic ehrlichiosis in Europe // Clin Microbiol Infect 2002; 8:763.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
16. Рудаков Н.В. Анаплазмы и анаплазмозы. Руководство для врачей. Омск, 2017.
18. Тетерин В.Ю. Оптимизация лабораторной диагностики и клинические особенности иксодовых клещевых боррелиозов, гранулоцитарного анаплазмоза человека: Автореф. дис. … канд. мед. наук. Москва, 2013. 23 с.
Поступила 12.04.2018 Принята 26.06.2018
DOI: 10.22363/2313-0245-2018-22-3-322-331
HUMAN GRANULOCYTOTROPIC ANAPLASMOSIS
Y.A. Klimova, N.A. Polovinkina, V.V. Konnov, D.S. Konnov
Peoples Friendship University of Russia (RUDN University)
N.A.Polovinkina. ORCID ID: 0000-0003-3917-9549 V.V.Konnov. ORCID ID: 0000-0002-4978-4139 D.S.Konnov. ORCID ID 0000-0003-0140-1255
1. Bakken J.S., Dumler S. Human granulocytic anaplasmosis. Infect Dis Clin North Am. 2015 Jun; 29(2): 341—355.
2. Volosach O.S. Human granulocytic anaplasmosis. Journal of Grodno State Medical University. 2015. No. 2 (50): 151—154.
7. URL:https://www.uptodate.com/contents/human-ehrlichiosis-andanaplasmosis.
10. Blanco J.R., Oteo J.A. Human granulocytic ehrlichiosis in Europe. Clin Microbiol Infect 2002; 8:763.
Federal Budget Institute of Science «Central Research Institute for Epidemiology». Moscow, 2006. 129.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
16. Rudakov N.V. Anaplasma and anaplasmosis. A guide for physicians. Omsk, 2017.
Согласно уровню знаний на данный момент, болезнью Лайма можно заразиться только в результате укуса клеща. Лица, страдающие болезнью Лайма, не заразны. Так как бактерии боррелии сначала находятся в средней кишке клеща, должно пройти некоторое время, чтобы они попали в кровь. Предположительно, после присасывания клеща до попадания в кровь хозяина должно пройти достаточно много часов. То есть, чем быстрее будет удален клещ, тем меньше риск заболеть болезнью Лайма.
На данный момент не существует прививки от болезни Лайма. Кроме того, можно инфицироваться несколько раз и иметь болезнь Лайма одновременно на нескольких стадиях.
Болезнь Лайма встречается во всем мире там, где живут клещи. Известно, что переносчиками болезни Лайма являются различные виды клещей. В Европе основным переносчиком является собачий клещ (Ixodes ricinus). Возбудитель распространен по-разному, согласно Институту Роберта Коха, в зависимости от региона от 5 до 35 процентов клещей носят в себе бактерии боррелии. Вероятность того, что после укуса клеща произойдет заражение болезнью Лайма, составляет среднем от 1,5 до 6 процентов. Чем дольше клещ пьет кровь, тем выше вероятность заражения.
Тем не менее, не каждый, вступивший в контакт с боррелиями в результате укуса клеща, заболевает. Во многих случаях организму удается контролировать болезнь – инфекция не вызывает никаких жалоб и вылечивается без последствий. Поэтому у многих здоровых людей в крови обнаруживаются защитные тела к возбудителю боррелиоза. До 25 процентов людей имеют в крови такие антитела, никогда не болея до этого болезнью Лайма. По-настоящему заболевает лишь от 0,5 до 1,5 процента укушенных клещом.
Диагностика болезни Лайма
Легче всего болезнь Лайма определяется врачом по мигрирующей эритеме (erythema migrans) – кругообразному обширному покраснению. Оно часто возникает в области укуса клеща, однако, может встречаться и на других участках тела. До появления мигрирующего покраснения может пройти около 28 дней. Поэтому важно наблюдать за местом укуса.
Если появилось мигрирующее покраснение и пациент вспомнил, что его укусил клещ, врач приступит к лечению болезни Лайма с помощью антибиотиков. Дополнительный лабораторный анализ крови не требуется, так как антитела к возбудителю боррелиоза на ранней стадии инфекции зачастую подтвердить еще не удается. И наоборот, наличие антител в крови не является подтверждением явной болезни Лайма, так как соответствующие вещества можно найти в крови даже здоровых людей.
Сложнее обстоит дело с диагностикой болезни Лайма на поздней стадии. Мигрирующее покраснение к этому моменту пропадает. Пациенты также больше не могут вспомнить, кусал ли их клещ, так как после этого могло пройти уже много лет. Поэтому врачу следует внимательнее присмотреться к симптомам своего пациента – таким как изменение состояния кожи, жалобы на боли в суставах или паралич лицевого нерва, а также принять во внимание другую клиническую картину с подобными признаками. Положительные результаты лабораторных исследований не являются надежной диагностикой и, к тому же, скрывают в себе опасность, что действительная причина жалоб останется незамеченной. Если в результате лабораторного исследования крови защитных тел к возбудителю боррелиоза не будет обнаружено, врач с вероятностью, граничащей с уверенностью может исключить болезнь Лайма на поздней стадии.
Лечение болезни Лайма
Так как болезнь Лайма является бактериальным заболеванием, оно очень хорошо лечится антибиотиками, особенно на ранней стадии. При более позднем проявлении или хронических симптомах зачастую требуется внутривенное введение антибиотиков на протяжении нескольких недель.